题目内容
【题目】(1)写出下列盐水解的离子方程式:
NaClO________________。
(NH4)2SO4________________。
Na2SO3 ________________。
AlCl3________________。
(2)25 ℃,将0.2 mol·L-1 HA溶液与0.2 mol·L-1 NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则:(下列空白填“>”“<”或“=”)
①混合溶液中,c(HA)________c(A-)。水电离产生的c(OH-) _____ 10-7 mol·L-1
②混合溶液中,c(HA)+c(A-)________0.1 mol·L-1。
③混合溶液中,由水电离出的c(OH-)___原0.2 mol·L-1 HA溶液中由水电离出的c(H+)。
④25 ℃时,如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度______NaA的水解程度。
【答案】ClO- + H2O ![]() HClO + OH- NH4+ + H2O
HClO + OH- NH4+ + H2O ![]() NH3·H2O + H+SO32-+ H2O
NH3·H2O + H+SO32-+ H2O ![]() HSO3- + OH- HSO3- + H2O
HSO3- + OH- HSO3- + H2O ![]() H2SO3+ OH-Al3+ + 3H2O
H2SO3+ OH-Al3+ + 3H2O ![]() Al(OH)3 + 3H+ <>= >>
Al(OH)3 + 3H+ <>= >>
【解析】
(1)次氯酸钠溶液中,次氯酸根离子是弱根离子,水解生成次氯酸和氢氧根离子,水解方程式为ClO-+H2OHClO+OH-;
硫酸铵溶液中,铵根离子是弱碱的阳离子,水解生成一水合氨和氢离子,水解方程式为NH4+ + H2O ![]() NH3·H2O + H+;
NH3·H2O + H+;
亚硫酸钠溶液中,亚硫酸根离子是弱酸根离子,多元弱酸根离子分步水解,亚硫酸根离子第一步水解生成亚硫酸氢根离子和氢氧根离子,水解方程式为SO32-+ H2O ![]() HSO3- + OH-;第二步水解生成亚硫酸和氢氧根离子,水解方程式为HSO3- + H2O
HSO3- + OH-;第二步水解生成亚硫酸和氢氧根离子,水解方程式为HSO3- + H2O ![]() H2SO3+ OH-;
H2SO3+ OH-;
氯化铝溶液中,铝离子是弱碱的阳离子,水解生成氢氧化铝和氢离子,水解方程式为Al3+ + 3H2O ![]() Al(OH)3 + 3H+;
Al(OH)3 + 3H+;
(2)25 ℃,将0.2 mol·L-1 HA溶液与0.2 mol·L-1 NaOH溶液等体积混合,完全反应所得溶液为NaA盐溶液,测得混合溶液中c(Na+)>c(A-),说明HA为弱酸,盐的水解是微弱的。
① 混合溶液为NaA盐溶液,盐的水解是微弱的,故c(HA) <c(A-),盐酸水解促进水的电离,故水电离产生的c(OH-)>10-7 mol·L-1;
② 根据物料守恒,混合溶液中,c(HA)+c(A-)= c(Na+)=![]() =0.1 mol·L-1;
=0.1 mol·L-1;
③ 盐的水解促进水的电离,酸溶液抑制水的电离,故混合溶液中,由水电离出的c(OH-)>原0.2 mol·L-1 HA溶液中由水电离出的c(H+);
④25 ℃时,如果取0.2 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,所得溶液为HA与NaA按1:1形成的溶液,测得混合溶液的pH<7,故HA的电离程度>NaA的水解程度。

【题目】硫元素的几种化合物存在下列转化关系:
![]()
下列判断不正确的是
A. 反应①中浓硫酸作氧化剂 B. 反应②表明SO2有酸性氧化物的性质
C. 反应③的原子利用率是100% D. 反应④稀H2SO4作还原剂
【题目】氢能是一种极具发展潜力的清洁能源,CH4—H2O催化重整是目前大规模制取氢气的重要方法。
(1)CH4-H2O催化重整:
反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1 = +210kJ/mol
CO(g)+3H2(g) H1 = +210kJ/mol
反应Ⅱ: CO(g)+ H2O(g)![]() CO2(g)+H2(g) H2 =﹣41kJ/mol
CO2(g)+H2(g) H2 =﹣41kJ/mol
①提高CH4平衡转化率的条件是________。
a.增大压强 b.加入催化剂 c.增大水蒸气浓度
②CH4、H2O催化重整生成CO2、H2的热化学方程式是________。
③在密闭容器中,将2.0 mol CO与8.0 mol H2O混合加热到800℃发生反应Ⅱ,达到平衡时CO的转化率是80%,其平衡常数为 _________。
(2)实验发现,其他条件不变,相同时间内,向催化重整体系中投入一定量的CaO可以明显提高H2的百分含量。做对比实验,结果如下图所示:
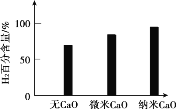
①投入CaO时,H2百分含量增大的原因是:_________。
②投入纳米CaO时,H2百分含量增大的原因是:__________。
(3)反应中催化剂活性会因积炭反应而降低,相关数据如下表:
反应 | Ⅰ | Ⅱ |
|
| |
H(kJ/mol) | +75 | ﹣173 |
①研究发现,如果反应Ⅰ不发生积炭过程,则反应Ⅱ也不会发生积炭过程。因此,若保持催化剂的活性,应采取的条件是_________。
②如果Ⅰ、Ⅱ均发生了积炭反应,通入过量水蒸气能有效清除积炭,反应的化学方程式是_________。