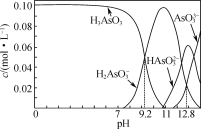
题目内容
【题目】工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用该原理处理污水,设计装置如图所示。下列说法正确的是
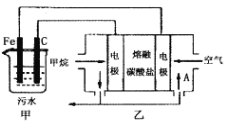
A.为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液
B.甲装置中Fe电极的反应为Fe-3e-=Fe3+
C.当乙装置中有1.6gCH4参加反应,则C电极理论上生成气体体积为4.48L
D.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
【答案】D
【解析】
甲装置为电解池,乙装置为原电池装置,原电池工作时,通入甲烷的一级为负极,发生氧化反应,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,通入氧气的一级为正极,发生还原反应,正极反应为O2+2CO2+4e-=2CO32-,电解池中Fe为阳极,发生Fe-2e-=Fe2+,阴极的电极反应为:2H++2e-=H2↑,二价铁离子具有还原性,能被氧气氧化到正三价,4Fe2++10H2O+O2=4Fe(OH)3↓+8H+,以此解答该题。
A.保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,加入能使导电能力增强的电解质必须是可溶于水的、显中性的盐,加入硫酸不能生成Fe(OH)3沉淀,故A错误;
B.电解池中Fe为阳极,发生Fe-2e-=Fe2+,故B错误;
C.阴极的电极反应为:2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的氢气产生,所以转移电子的物质的量为4mol,根据电池的负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,当乙装置中有1.6 gCH4参加反应,即0.1mol甲烷参加反应时,有0.8mol电子转移,则C电极理论上生成气体在标准状况下为8.96L,故C错误;
D.电池是以熔融碳酸盐为电解质,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,正极反应为O2+2CO2+4e-=2CO32-,可以循环利用的物质只有二氧化碳,故D正确;
故答案为D。