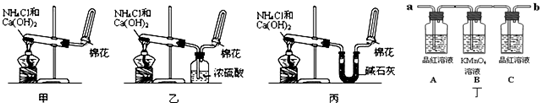
题目内容
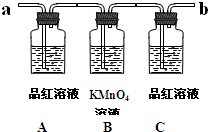 已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:
已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
如图为验证浓硫酸与木炭在加热条件下,反应产物中是否含有SO2和CO2的部分装置.
(1)实验时,从
(2)可观察到A瓶的溶液
(3)C瓶溶液的作用是
分析:(1)检验和洗气装置中导气管遵循“长进短出”的原则;
(2)二氧化硫具有漂白性,能使品红溶液褪色;
(3)二氧化硫能使品红溶液褪色,可以用品红溶液检验二氧化硫是否存在.
(2)二氧化硫具有漂白性,能使品红溶液褪色;
(3)二氧化硫能使品红溶液褪色,可以用品红溶液检验二氧化硫是否存在.
解答:解:(1)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,所以不能用澄清石灰水鉴别二氧化碳和二氧化硫,但二氧化硫具有漂白性、还原性,所以可以先检验二氧化硫,再除去二氧化硫,最后再检验二氧化碳,检验和洗气装置中导气管遵循“长进短出”的原则,所以实验时,从b端连接盛有澄清石灰水的实验装置,
故答案为:b;
(2)二氧化硫能和有色物质反应生成无色物质而具有漂白性,二氧化硫能使品红溶液褪色,所以A装置中溶液褪色,故答案为:褪色;
(3)二氧化硫能使品红溶液褪色,可以用品红溶液检验二氧化硫是否存在,所以C装置中品红溶液是检验二氧化硫是否除尽,如果未除尽会干扰实验,故答案为:检验SO2是否除尽.
故答案为:b;
(2)二氧化硫能和有色物质反应生成无色物质而具有漂白性,二氧化硫能使品红溶液褪色,所以A装置中溶液褪色,故答案为:褪色;
(3)二氧化硫能使品红溶液褪色,可以用品红溶液检验二氧化硫是否存在,所以C装置中品红溶液是检验二氧化硫是否除尽,如果未除尽会干扰实验,故答案为:检验SO2是否除尽.
点评:本题考查了二氧化硫和品红溶液的实验,明确实验原理是解本题关键,注意二氧化硫、二氧化碳混合气体中检验气体的先后顺序、检验方法,很多同学往往忘记二氧化硫也能使澄清石灰水变浑浊而导致错误,注意二氧化硫和次氯酸漂白原理的区别,二氧化硫不能使酸碱指示剂褪色,为易错点.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
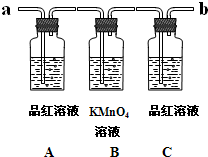 已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4
已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4