��Ŀ����
����Ŀ��������ѧ��֪ʶ��ա�
(1)��֪ͭ�ڳ������ܱ�ϡHNO3�ܽ⣺3Cu + 8HNO3=3Cu(NO3)2 + 2NO��+ 4H2O
����˫���ŷ���ʾ��������ת�Ƶķ������Ŀ(�ڻ�ѧ����ʽ�ϱ��)______��
���뽫������Ӧ��д�����ӷ���ʽ��_________________________________________��
��19.2gͭ��ϡ������ȫ��Ӧ�����ɵ������ڱ�״���µ����Ϊ_________________L����4 mol HNO3�μӷ�Ӧ����ù���ת�Ƶ��ӵ���ĿΪ__________________________��
(2)��״���£�44.8 L��O2��CO2��ɵĻ�����������Ϊ82g����O2������Ϊ_________g���û�������ƽ��Ħ������Ϊ_______________________��
(3)3.4g NH3��������ԭ����Ŀ���״����__________ L CH4������ԭ������ͬ��
���𰸡�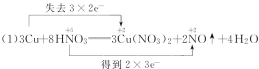 3Cu+8H++2NO3-=3Cu2++2NO��+4H2O 4.48 3NA��1.806��1024 16 41g/mol 3.36
3Cu+8H++2NO3-=3Cu2++2NO��+4H2O 4.48 3NA��1.806��1024 16 41g/mol 3.36
��������
��1��Cu+4HNO3�TCu��NO3��2+2NO2��+2H2O�У�CuԪ�صĻ��ϼ��� 0����Ϊ+2�ۣ�NԪ�صĻ��ϼ���+5�۽���Ϊ+4�ۣ��÷�Ӧ��ת��2mol���ӣ�������������Ԫ�صĻ��ϼ۵ı仯�ж�����������ԭ�����Լ��μ�������ԭ��Ӧ����������ʵ�����
��2������n=![]() ����CO��CO2��ɵĻ����������ʵ�������CO��CO2�����ʵ����ֱ�Ϊxmol��ymol�����ݶ������ʵ������������з��̼���x��y��ֵ����������CO��CO2�����ʵ���֮�ȣ�����M=
����CO��CO2��ɵĻ����������ʵ�������CO��CO2�����ʵ����ֱ�Ϊxmol��ymol�����ݶ������ʵ������������з��̼���x��y��ֵ����������CO��CO2�����ʵ���֮�ȣ�����M=![]() �����������ƽ��Ħ��������
�����������ƽ��Ħ��������
��3������n=![]() ��������������ʵ������ٸ���N=nNA��������а��������������е���ԭ����Ŀ����ϼ���ķ��ӽṹ�����������ʵ���������V=nVm�����������
��������������ʵ������ٸ���N=nNA��������а��������������е���ԭ����Ŀ����ϼ���ķ��ӽṹ�����������ʵ���������V=nVm�����������
��1���ٻ��ϼ�����Ԫ��Cuʧ���ӣ����ϼ۽���Ԫ��N�õ����ӣ����ϼ�������=���ϼ۽�����=ת�Ƶ�����=6������ת��������£�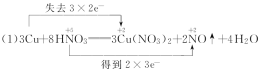 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
����3Cu+8HNO3�T3Cu��NO3��2+2NO��+4H2O��Ӧ�У�HNO3��Cu��NO3��2����ˮ�ҵ��룬Ӧд�����ӵ��γɣ���д������ӷ���ʽΪ3Cu+8H++2NO3-�T3Cu2++2NO��+4H2O���ʴ�Ϊ��3Cu+8H++2NO3-�T3Cu2++2NO��+4H2O��
��ͭ�����ʵ���Ϊ0.3mol���÷�Ӧ��CuԪ����0�����ߵ�+2�ۣ���0.3mol Cuʧȥ�ĵ���Ϊ0.3mol����2-0��=0.6mol����NO�����ʵ���Ϊn���ɵ����غ��֪��0.3mol��2=n����5-2�������n=0.2mol����NO�����Ϊ4.48L���ɷ���ʽ3Cu+8HNO3�T3Cu��NO3��2+2NO��+4H2O��֪8 mol����μӷ�Ӧ��ת��6mol���ӣ������4mol����μӷ�Ӧ��ת�Ƶ���3mol������Ϊ3NA��1.806��1024���ʴ�Ϊ��4.48��3NA��1.806��1024��
��2�������44.8 L��O2��CO2��ɵĻ����������ʵ���Ϊ![]() =2mol����O2��CO2�����ʵ����ֱ�Ϊxmol��ymol����x+y=2mol��32x+44y=82g��
=2mol����O2��CO2�����ʵ����ֱ�Ϊxmol��ymol����x+y=2mol��32x+44y=82g��
��ã�x=0.5��y=1.5����������O2�ĵ���Ϊ0.5mol��32g/mol=16g����������ƽ��Ħ������Ϊ��![]() =41g/mol���ʴ�Ϊ��16��41g/mol��
=41g/mol���ʴ�Ϊ��16��41g/mol��
��3����������Է���������17����Ħ��������17g/mol����3.4g���������ʵ���Ϊ��n��NH3��=![]() =0.2mol��������ԭ�ӵ���ĿΪ��N��H��=3N��NH3��=0.6NA���백������Hԭ����Ŀ��ȵ�CH4�����ʵ���
=0.2mol��������ԭ�ӵ���ĿΪ��N��H��=3N��NH3��=0.6NA���백������Hԭ����Ŀ��ȵ�CH4�����ʵ���![]() =0.15NA����CH4�����=0.15mol��22.4L/mol=3.36L���ʴ�Ϊ�� 3.36��
=0.15NA����CH4�����=0.15mol��22.4L/mol=3.36L���ʴ�Ϊ�� 3.36��

 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�