题目内容
【题目】Fe、HCN与K2CO3在一定条件下发生如下反应:
Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为___________________。
(2)配合物K4Fe(CN)6的中心离子是____________,该离子价电子的基态电子排布图为____________。
(3)lmol HCN分子中含有σ键的数目为____________,HCN分子中碳原子轨道杂化类型是____________,与CN-互为等电子体的阴离子是____________。
(4)K2CO3中阴离子的空间构型为____________,其中碳原子的价层电子对数为____________。
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞有__________个氢键,若氢键键长为d nm,则晶体密度(g/cm3)计算式为____________(用NA表示阿伏伽德罗常数的值)。

【答案】 C Fe2+ ![]() 1.202×1024 sp杂化 C22— 平面三角形 3 16
1.202×1024 sp杂化 C22— 平面三角形 3 16 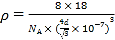
【解析】(1)此化学方程式中涉及的第二周期元素有C、N、O,三种元素的非金属性越强,电负性越大,则电负性由小到大的顺序为C<N<O;
(2)配合物K4Fe(CN)6的中心离子是 Fe2+,该离子价电子的基态电子排布图为 ;
;
![]() (3)HCN的结构式为H—C N,lmol HCN分子中含有σ键的数目为2NA,HCN分子中碳原子轨道杂化类型是sp杂化,有二个原子和10个价电子,则与CN-互为等电子体的阴离子有 C22—;
(3)HCN的结构式为H—C N,lmol HCN分子中含有σ键的数目为2NA,HCN分子中碳原子轨道杂化类型是sp杂化,有二个原子和10个价电子,则与CN-互为等电子体的阴离子有 C22—;
(4)CO32-中碳原子价层电子对个数=3+![]() (4+2-3×2)=3,且不含孤电子对,所以C原子采用sp2杂化,空间构型为平面三角形;
(4+2-3×2)=3,且不含孤电子对,所以C原子采用sp2杂化,空间构型为平面三角形;
(5)每个冰晶胞平均占有分子个数=4+![]() ×8+6×
×8+6×![]() =8,H2O的氧原子中含有2个σ键和2个孤电子对,金刚石中每个碳原子含有4个σ键且没有孤电子对,所以水中的O和金刚石中的C都是sp3杂化,且水分子间的氢键具有方向性,每个水分子中一个氧原子可以和另外2个水分子中的氢原子形成2个氢键,2个氢原子可以和另外2个水分子中的氧原子形成氢键,所以每个水分子可与相邻的4个水分子形成4个氢键,即平均每个水分子可形成2个氢键,每个晶胞中共有2×8=16个氢键;若氢键键长为d nm,晶胞的对角线为4dnm,设晶胞边长为anm,则a=
=8,H2O的氧原子中含有2个σ键和2个孤电子对,金刚石中每个碳原子含有4个σ键且没有孤电子对,所以水中的O和金刚石中的C都是sp3杂化,且水分子间的氢键具有方向性,每个水分子中一个氧原子可以和另外2个水分子中的氢原子形成2个氢键,2个氢原子可以和另外2个水分子中的氧原子形成氢键,所以每个水分子可与相邻的4个水分子形成4个氢键,即平均每个水分子可形成2个氢键,每个晶胞中共有2×8=16个氢键;若氢键键长为d nm,晶胞的对角线为4dnm,设晶胞边长为anm,则a=![]() nm,晶胞的体积为(anm)3,晶胞的质量为
nm,晶胞的体积为(anm)3,晶胞的质量为![]() ,晶体密度=
,晶体密度=![]() ÷(anm)3=
÷(anm)3=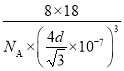 g/cm3。
g/cm3。
点睛:根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=![]() (a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;中心原子的杂化类型为sp2,说明该分子中心原子的价层电子对个数是3,无孤电子对数,空间构型是平面三角形。
(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;中心原子的杂化类型为sp2,说明该分子中心原子的价层电子对个数是3,无孤电子对数,空间构型是平面三角形。

 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案