题目内容
3.将氢氧化钠稀溶液滴加到醋酸稀溶液中,对于混合液中有关物理量与性质的变化趋势,表示正确的是( )| A. | 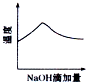 | B. | 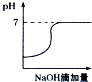 | C. |  | D. |  |
分析 A.酸碱中和反应是放热反应;
B.醋酸是弱酸,常温下溶液的pH较小,和NaOH发生中和反应生成盐,pH升高,当氢氧化钠过量时溶液呈碱性;
C.溶液导电能力与离子浓度成正比;
D.NaOH不足量时,NaOH的物质的量是0;醋酸钠能水解生成醋酸,所以醋酸浓度不能是0,据此结合选项内容进行回答.
解答 解:A.氢氧化钠和醋酸发生中和反应,反应放热,当酸反应完成后,再加碱,相当于往热水中加入冷水,温度降低,故A正确;
B.醋酸中滴加氢氧化钠酸性减弱pH增大,当酸碱恰好发生中和时,pH突变,醋酸完全反应后,得到的醋酸钠溶液显示碱性,pH>7,故B错误;
C.溶液导电能力与离子浓度成正比,醋酸中滴加氢氧化钠,相当于弱电解质溶液变成强电解质溶液,但是醋酸完全转化为醋酸后,再加入氢氧化钠,溶液的体积变大为主因,导致离子浓度减小,因此导电能力会略微降低,故C错误;
D.醋酸中滴加氢氧化钠,氢氧化钠和醋酸发生反应了,当醋酸剩余时,氢氧化钠物质的量0,醋酸中滴加氢氧化钠,即便醋酸完全反应,醋酸钠还是有微弱的水解,醋酸的浓度不可能为0,故D错误.
故选:A.
点评 本题考查酸碱混合定性判断,题目难度中等,注意:①酸碱中和反应是放热反应;②醋酸中加入氢氧化钠导电性增强,氨水中加入强酸导电性增强,硫酸中滴入氢氧化钡溶液导电性逐渐减弱,到最弱后,再逐渐增强;③强碱弱酸盐溶液中一定有弱酸分子存在,强酸弱碱盐溶液中也一定有弱碱存在,只不过量少而已.

练习册系列答案
相关题目
13.运载“神舟八号”飞船的火箭主要燃料是偏二甲肼(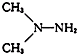 )偏二甲肼的同分异构体中含碳碳单键的化合物种类共有( )
)偏二甲肼的同分异构体中含碳碳单键的化合物种类共有( )
 )偏二甲肼的同分异构体中含碳碳单键的化合物种类共有( )
)偏二甲肼的同分异构体中含碳碳单键的化合物种类共有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
14.下列情况可能引起水污染的是( )
①农业生产中农药化肥使用不当
②工业生产中废气、废液、废渣排放不当
③石油运输过程中因泄漏流入江河
④生活污水的任意排放
⑤原子核反应的残留物随意排放.
①农业生产中农药化肥使用不当
②工业生产中废气、废液、废渣排放不当
③石油运输过程中因泄漏流入江河
④生活污水的任意排放
⑤原子核反应的残留物随意排放.
| A. | ①③⑤ | B. | ①③④⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
11.以NA表示阿佛加德罗常数的值,下列说法中正确的是( )
| A. | 含53g碳酸钠的水溶液中含NA个CO32- | |
| B. | 0.1molOH-含NA个电子 | |
| C. | 1.8g重水(D2O)中含NA个中子 | |
| D. | 一定条件下的密闭容器中,足量N2与3mol H2充分反应可生成NH3 2NA |
18.下列实验操作或对实验事实的描述不正确的是( )(填序号)
| A. | 不宜用瓷坩埚灼烧氢氧化钠或碳酸钠 | |
| B. | 使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大 | |
| C. | 分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出 | |
| D. | 用托盘天平称量11.74g氯化钠晶体 | |
| E. | 用结晶法分离硝酸钾和氯化钠的混合物 |
8.下列物质中先用硝酸酸化至酸性,再加入硝酸银溶液,有白色沉淀生成的是( )
| A. | 氯酸钾溶液 | B. | 溴化钠溶液? | ||
| C. | 氯乙烷 | D. | 氯仿和碱溶液煮沸后的溶液 |
15.下列关于能量转换的认识中不正确的是( )
| A. | 电解水生成氢气和氧气时,电能转变成化学能 | |
| B. | 白炽灯工作时电能全部转化成光能 | |
| C. | 绿色植物光合作用过程中太阳能转变成化学能 | |
| D. | 煤燃烧时化学能主要转变成热能 |
13.下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )
| A. | 10℃20mL 0.3mol•L-1的盐酸溶液 | B. | 20℃30mL 0.2mol•L-1的盐酸溶液 | ||
| C. | 20℃20mL 0.2 mol•L-1的盐酸溶液 | D. | 20℃30mL 0.4 mol•L-1的盐酸溶液 |
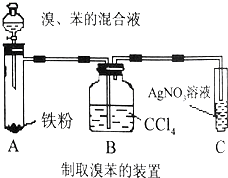 苯是一种重要的有机化工原料,广泛用于合成工业产品.回答下列问题:
苯是一种重要的有机化工原料,广泛用于合成工业产品.回答下列问题: