题目内容
【题目】I 已知:HCN(aq)+NaOH(aq)═NaCN(aq)+H2O(l)△H=﹣12.1kJmol﹣1;HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=﹣55.6kJmol﹣1。则在水溶液中HCN![]() H++ CN-电离的△H为_______________kJmol﹣1
H++ CN-电离的△H为_______________kJmol﹣1
II 用右图所示装置进行中和热测定实验,请回答下列问题:
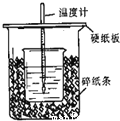
(1)大小烧杯之间填满碎泡沫塑料的作用是_____________,从实验装置上看,图中缺少的一种玻璃仪器______________。
(2)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等”.“不相等”),所求中和热______________ (填“相等”.“不相等”),若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会_____________ (填“偏大”、“偏小”、“不受影响”)。
【答案】 +43.5 保温、隔热、减少实验过程中的热量损失 环形玻璃搅拌棒 不相等 相等 偏小
【解析】I、利用盖斯定律进行计算,将已知两个热化学方程式相减得到HCN在水溶液中电离的电离方程式。
HCN(aq)+OH﹣(aq)═CN﹣(aq)+H2O(l)△H=﹣12.1kJmol﹣1…①
H+(aq)+OH﹣(aq)═H2O(l)△H=﹣55.6kJmol﹣1…②
HCN电离方程式为,HCN![]() H++CN﹣,
H++CN﹣,
用①﹣②可得HCN电离的热化学方程式为HCN(aq)H+(aq)+CN﹣(aq)△H=﹣12.1kJmol﹣1﹣(﹣55.6kJmol﹣1)=+43.5kJmol﹣1,故选A。
II、(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是保温、隔热、减少实验过程中的热量损失;由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒。
故答案为:保温、隔热、减少实验过程中的热量损失;环形玻璃搅拌棒;
(2)若用60mL 0.25molL﹣1 H2SO4溶液跟50mL 0.55molL﹣1 NaOH溶液反应,与上述实验相比,生成水增多,所放出的热量偏高,即不相等;但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;醋酸是弱酸,电离过程吸热,所以用50mL0.50molL﹣1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会减小。
故答案为:不相等;相等;偏小。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律.根据下表中短周期元素的原子半径和主要化合价,回答表后的问题.
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10﹣10m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
﹣2 | ﹣3 | ﹣1 | ﹣3 |
(1)上述元素中与元素⑧处于同一周期的有(填元素符号)
(2)元素①在元素周期表中的位置是
(3)①④⑦三种元素的氢化物的稳定性由强到弱的顺序为(填化学式)
(4)请写出下列元素形成的常见化合物的电子式: ③⑤②⑤③⑦
(5)请写出⑤⑧两种元素的最高价氧化物对应水化物间反应的离子方程式: .
