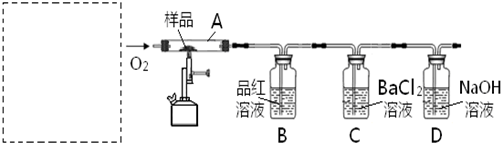
题目内容
氧化还原反应实际上包括氧化反应和还原反应两个过程(即两个半反应),某体系的一个半反应为:NO3-+4H++3e-═NO↑+2H2O.该氧化还原反应中的还原剂是下列四种物质中的一种:KMnO4,Na2CO3,KI,Fe2(SO4)3.
(1)若氧化产物为单质,则氧化反应(半反应)可以表示为______
(2)该氧化还原反应的离子方程式为______;
(3)若反应生成了0.3molH2O,则反应中转移电子的物质的量为______mol
(4)某学生在实验室进行上述氧化还原反应时测得还原剂的实际用量不足氧化剂实际用量的3/4,试从生成物变化的角度分析可能的原因:______.
解:(1)NO3+4H++3e-═NO+2H2O,该反应中硝酸发生还原反应,所以所选的物质必须具有还原性,KMnO4、Fe2(SO4)3具有氧化性,Na2CO3和酸不发生氧化还原反应,所给四种物质中只有KI具有还原性,则氧化反应应为I-被氧化,氧化反应为2I--2e-=I2,故答案为:2I--2e-=I2;
(2)将两个半反应相加可得氧化还原反应的离子方程式为2NO3-+8H++6I-=2NO↑+4H2O+3I2,故答案为:2NO3-+8H++6I-=2NO↑+4H2O+3I2;
(3)有反应的离子方程式可知,若反应生成了4molH2O,则转移6mol电子,生成0.3molH2O,则反应中转移电子的物质的量为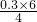 mol=0.45mol,故答案为:0.45;
mol=0.45mol,故答案为:0.45;
(4)反应中还原剂与氧化剂物质的量之比为3,而实际用量不足氧化剂实际用量的 ,说明消耗的硝酸多,KI少,可能原因是硝酸浓度角度,被还原为NO2,I被氧化为更高化合价,生成KIO3等,
,说明消耗的硝酸多,KI少,可能原因是硝酸浓度角度,被还原为NO2,I被氧化为更高化合价,生成KIO3等,
故答案为:生成物中可能存在部分NO2、KIO3等物质.
分析:反应NO3-+4H++3e-═NO↑+2H2O中N元素化合价降低,被还原,题中所给四种物质中只有KI具有还原性,则氧化反应应为I-被氧化,总反应为2NO3-+8H++6I-=2NO↑+4H2O+3I2,反应中N元素的化合价降低,I元素的化合价升高,从化合价变化的角度计算电子转移的数目.
点评:本题考查了氧化还原反应方程式的配平和反应方程式的有关计算,配平方程式时注意元素化合价的与物质的性质之间的关系,题目难度中等.
(2)将两个半反应相加可得氧化还原反应的离子方程式为2NO3-+8H++6I-=2NO↑+4H2O+3I2,故答案为:2NO3-+8H++6I-=2NO↑+4H2O+3I2;
(3)有反应的离子方程式可知,若反应生成了4molH2O,则转移6mol电子,生成0.3molH2O,则反应中转移电子的物质的量为
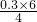 mol=0.45mol,故答案为:0.45;
mol=0.45mol,故答案为:0.45; (4)反应中还原剂与氧化剂物质的量之比为3,而实际用量不足氧化剂实际用量的
 ,说明消耗的硝酸多,KI少,可能原因是硝酸浓度角度,被还原为NO2,I被氧化为更高化合价,生成KIO3等,
,说明消耗的硝酸多,KI少,可能原因是硝酸浓度角度,被还原为NO2,I被氧化为更高化合价,生成KIO3等,故答案为:生成物中可能存在部分NO2、KIO3等物质.
分析:反应NO3-+4H++3e-═NO↑+2H2O中N元素化合价降低,被还原,题中所给四种物质中只有KI具有还原性,则氧化反应应为I-被氧化,总反应为2NO3-+8H++6I-=2NO↑+4H2O+3I2,反应中N元素的化合价降低,I元素的化合价升高,从化合价变化的角度计算电子转移的数目.
点评:本题考查了氧化还原反应方程式的配平和反应方程式的有关计算,配平方程式时注意元素化合价的与物质的性质之间的关系,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
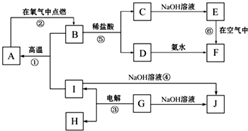 A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白: CaO+CO2 ㈡2CaO+2SO2+O2=2CaSO4
CaO+CO2 ㈡2CaO+2SO2+O2=2CaSO4