题目内容
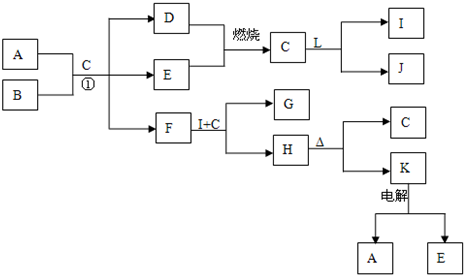
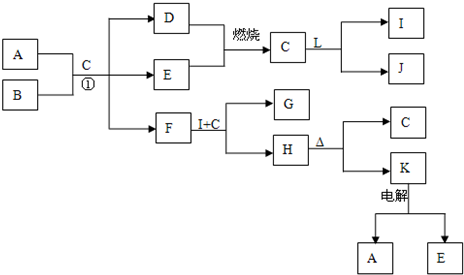
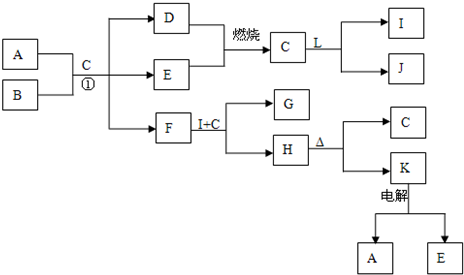
下列框表中的A--L中是中学化学中常见的物质,所有物质均由短周期元素组成.已知常温、常压下,C为无色液体,D、E、L均为气体单质,H是一种可溶于盐酸和氢氧化钠溶液的白色固体,J是具有强氧化性的一元弱酸,A--L可发生如下转化:
请回答下列问题:
(1)J的电子式______
(2)写出C、L反应转化为I和J的离子方程式______
(3)H是一种用于治疗胃酸过多的药物的主要成分,其治疗原理用离子方程式表示______
(4)写出F与I、C转化为G和H的离子方程式______
(5)如果A、B的物质的量之比为2:1,写出①的化学反应方程式______.
解:常温、常压下,C为无色液体,应为H2O,则D、E为H2、O2中的一种,J是具有强氧化性的一元弱酸,应为HClO,则L为Cl2,I为HCl,H是一种可溶于盐酸和氢氧化钠溶液的白色固体,且能加热分解,则H为Al(OH)3,K为Al2O3,电解生成的E为O2,所以D为H2,F能和盐酸反应生成Al(OH)3,则F为NaAlO2,所以B为Na2O2,A、B和水混合时,分别生成H2、O2、NaAlO2,
NaAlO2和盐酸反应生成Al(OH)3和NaCl,则G为NaCl,则
(1)J是具有强氧化性的一元弱酸,应为HClO,电子式为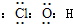 ,故答案为:
,故答案为: ;
;
(2)氯气和水反应生成盐酸和次氯酸,其中次氯酸为弱酸,反应的离子方程式为Cl2+H2O=H++Cl-+HClO,
故答案为:Cl2+H2O=H++Cl-+HClO;
(3)Al(OH)3具有两性,与酸反应生成盐和水,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(4)NaAlO2和盐酸反应生成Al(OH)3和NaCl,反应的离子方程式为AlO2-+H++H2O=Al(OH)3↓,
故答案为:AlO2-+H++H2O=Al(OH)3↓;
(5)如果A、B的物质的量之比为2:1,根据元素质量守恒,可写出反应方程式为2Na2O2+4Al+6H2O=4NaAlO2+6H2↑+O2↑,
故答案为:2Na2O2+4Al+6H2O=4NaAlO2+6H2↑+O2↑.
分析:常温、常压下,C为无色液体,应为H2O,则D、E为H2、O2中的一种,J是具有强氧化性的一元弱酸,应为HClO,则L为Cl2,I为HCl,H是一种可溶于盐酸和氢氧化钠溶液的白色固体,且能加热分解,则H为Al(OH)3,K为Al2O3,电解生成的E为O2,所以D为H2,F能和盐酸反应生成Al(OH)3,则F为NaAlO2,所以B为Na2O2,A、B和水混合时,分别生成H2、O2、NaAlO2,NaAlO2和盐酸反应生成Al(OH)3和NaCl,则G为NaCl,结合物质的性质解答该题.
点评:本题考查无机物的推断,题目难度较大,正确推断出各物质是解答该题的关键,注意提干中个物质的特性.
NaAlO2和盐酸反应生成Al(OH)3和NaCl,则G为NaCl,则
(1)J是具有强氧化性的一元弱酸,应为HClO,电子式为
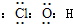 ,故答案为:
,故答案为: ;
;(2)氯气和水反应生成盐酸和次氯酸,其中次氯酸为弱酸,反应的离子方程式为Cl2+H2O=H++Cl-+HClO,
故答案为:Cl2+H2O=H++Cl-+HClO;
(3)Al(OH)3具有两性,与酸反应生成盐和水,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(4)NaAlO2和盐酸反应生成Al(OH)3和NaCl,反应的离子方程式为AlO2-+H++H2O=Al(OH)3↓,
故答案为:AlO2-+H++H2O=Al(OH)3↓;
(5)如果A、B的物质的量之比为2:1,根据元素质量守恒,可写出反应方程式为2Na2O2+4Al+6H2O=4NaAlO2+6H2↑+O2↑,
故答案为:2Na2O2+4Al+6H2O=4NaAlO2+6H2↑+O2↑.
分析:常温、常压下,C为无色液体,应为H2O,则D、E为H2、O2中的一种,J是具有强氧化性的一元弱酸,应为HClO,则L为Cl2,I为HCl,H是一种可溶于盐酸和氢氧化钠溶液的白色固体,且能加热分解,则H为Al(OH)3,K为Al2O3,电解生成的E为O2,所以D为H2,F能和盐酸反应生成Al(OH)3,则F为NaAlO2,所以B为Na2O2,A、B和水混合时,分别生成H2、O2、NaAlO2,NaAlO2和盐酸反应生成Al(OH)3和NaCl,则G为NaCl,结合物质的性质解答该题.
点评:本题考查无机物的推断,题目难度较大,正确推断出各物质是解答该题的关键,注意提干中个物质的特性.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同)__________。
| A.生成CH3OH的速率与消耗CO的速率相等 |
| B.混合气体的密度不变 |
| C.混合气体的相对平均分子质量不变 |
| D.CH3OH、CO、H2的浓度都不再发生变化 |
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO) =" 0.2" mol/L,则CO的转化率为__________,此时的温度为__________。
(3)要提高CO的转化率,可以采取的措施是__________。
a. 升温 b. 加入催化剂
c. 增加CO的浓度 d. 恒容下加入H2使容器内压强变大
e. 分离出甲醇 f. 恒容下加入惰性气体使容器内压强变大
(4)在250℃时,某时刻测得该温度下的密闭容器中各物质的物质的量浓度见下表:
| CO | H2 | CH3OH |
| 0.5 mol·L-1 | 2mol·L-1 | 6mol·L-1 |
(5)如图1所示,甲为恒容密闭容器,乙为恒压密闭容器。在甲、乙两容器中分别充入等物质的量的H2和CO,使甲、乙两容器初始容积相等。在相同温度下发生上述反应,并维持反应过程中温度不变。在图2中标出甲、乙两容器中CO的转化率随时间变化的对应图像(在图2相应曲线右侧的框格中分别标注“甲”、“乙”)。

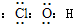
 CO(g)+3H2(g)△H=+206.1kJ?mol-1.
CO(g)+3H2(g)△H=+206.1kJ?mol-1.