题目内容
在硝酸生产过程中所排放出来的废气中含有NO和NO2,它们污染环境,现有氨催化还原法将它们转化为无毒气体(填名词)_____直接排放空气中,写出有关反应方程式:______。假设NO和NO2物质的量________之比恰好为1∶1,则两者的混合物相当于一种酸酐,写出由烧碱溶液吸收这种酸酐的化学方程式:________。
氮气;6NO2+8NH3![]() 7N2+12H2O
7N2+12H2O
6NO+4NH3![]() 5N2+6H2O
5N2+6H2O
NO+NO2+2NaOH====2NaNO2+H2O
或(N2O3+2NaOH====2NaNO2+H2O)
解析:
正价的氮的化合物与负价的氮的化合物往往可以发生反应生成单质N2。所以NO2与NH3在催化剂作用下生成无毒的N2单质。
第二空:NO和NO2物质的量之比为1∶1的混合物,相当于亚硝酸酸酐N2O3,其中N的化合价为+3价,与NaOH溶液反应,生成相应的价态的盐和水。反应式:N2O3+2NaOH====2NaNO2+H2O

 初中学业考试导与练系列答案
初中学业考试导与练系列答案| 城市 | 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 甲 | 55 | SO2 | II | 良 |
实验一:用如图所示装置进行实验.
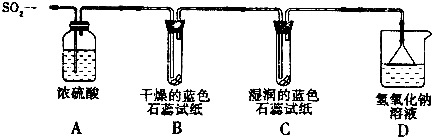
①A装置的作用是
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变
③D装置的作用是
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的显
(1)酸雨造成的危害是:
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为
本市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加入
| 污染指数 | 首要污染物 | 空气质量等级 | 空气质量状况 |
| 55 | SO2 | Ⅱ | 良 |
(1)用如图所示装置进行实验.
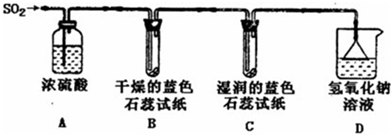
①A装置的作用是
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变
③D装置的作用是
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.
(5)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为
(16分)下表是甲城市某日空气质量报告:
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 甲 | 55 | SO2 | II | 良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
【探究实验】 实验一:用下图所示装置进行实验。
①A装置的作用是 (填“干燥”或“氧化”)SO2气体。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸
变 色,说明SO2与水反应生成一种酸,该酸的化学式是 。
③D装置的作用是 。若实验中向装置内通入标准状况下1.12L SO2气体,且NaOH溶液过量。最多能生成Na2SO3的物质的量为 mol。(反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O)
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的pH 7(填“>”、“=”或“<”=,然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终生成H2SO4。
【查阅资料】SO2形成酸雨的另一途径; SO2与空气中的O2在飘尘的作用下反应生成SO3,
SO3溶于降水生成H2SO4。在此过程中飘尘作催化剂。
【探究结论】SO2与空气中的氧气、水反应生成硫酸而形成酸雨。本市可能易出现酸雨。
【知识联想】
(1)酸雨造成的危害是: (举一例)。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因。
【提出建议】本市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加人 (填“水”或“乙醇”)。
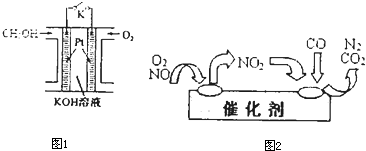

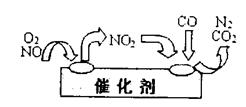
 L(标准状况)该尾气需42.5gNH3,则x= 。
L(标准状况)该尾气需42.5gNH3,则x= 。