题目内容
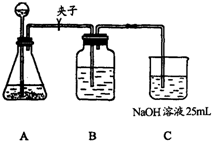
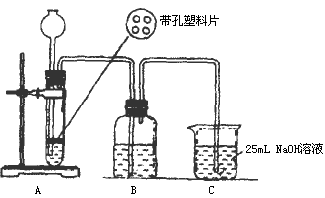
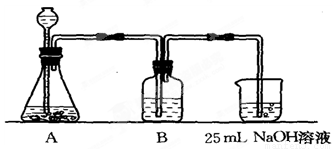
某学生拟用50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量而生成NaHCO3,他设计了如下实验步骤: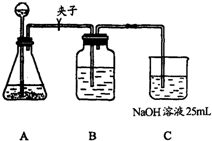
①取25mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
②小心煮沸溶液1~2分钟排出溶液中溶解的二氧化碳气体;
③在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合.
(1)他能否制得较纯净的Na2CO3?______.
理由是______.
按它的设计,第①步实验装置如图所示:
(2)装置A使用的试剂是石灰石和盐酸溶液.可否使用纯碱代替石灰石?______,原因是______.
(3)装置B使用的试剂是______,作用是______.
(4)有人认为实验步骤②③的顺序对调,即先混合,再煮沸,更合理,你认为对吗?为什么?______.
解:(1)氢氧化钠和过量二氧化碳反应生成碳酸氢钠,生成的碳酸氢钠的物质的量与氢氧化钠 的物质的量相等,且碳酸氢钠与氢氧化钠反应恰好1:1反应生成碳酸钠,所以能.
故答案为:能;NaHCO3+NaOH=Na2CO3+H2O二者恰好完全反应.
(2)碳酸钠是粉末状的固体,相同质量的石灰石和碳酸钠,碳酸钠的接触面积大,所以反应速率快,不利于二氧化碳的吸收,所以不能.
故答案为:不能;纯碱与盐酸反应太快,不利于CO2的吸收.
(3)该反应是放热反应,随着反应的进行,溶液的温度升高,盐酸具有挥发性,所以生成的二氧化碳中含有氯化氢气体,为了除去二氧化碳中的氯化氢气体又不引进新的杂质,用饱和的碳酸氢钠溶液吸收氯化氢.
故答案为:饱和的NaHCO3溶液;除去氯化氢气体.
(4)如果实验步骤②③的顺序对调,溶液中溶解了部分二氧化碳,二氧化碳和氢氧化钠反应,使氢氧化钠的量减少,混合液中碳酸氢钠和氢氧化钠的物质的量不相等,所以不能恰好完全反应生成碳酸钠,所以不对.
故答案为:不对,过量的CO2消耗NaOH,不能使NaHCO3全部转化为Na2CO3.
分析:(1)根据碳酸氢钠与氢氧化钠之间的关系分析;
(2)根据碳酸钠的性质分析;
(3)根据气体的成分及实验目的分析;
(4)二氧化碳的性质及碳酸氢钠和氢氧化钠的物质的量之间的关系分析.
点评:本题考查了钠的重要化合物的性质,要注意的是:除去二氧化碳中的氯化氢气体不能用饱和的碳酸钠溶液,虽然氯化氢和碳酸钠反应,但二氧化碳和碳酸钠反应生成,减少了二氧化碳的量,所以不用饱和的碳酸钠溶液吸收二氧化碳中的氯化氢气体.
故答案为:能;NaHCO3+NaOH=Na2CO3+H2O二者恰好完全反应.
(2)碳酸钠是粉末状的固体,相同质量的石灰石和碳酸钠,碳酸钠的接触面积大,所以反应速率快,不利于二氧化碳的吸收,所以不能.
故答案为:不能;纯碱与盐酸反应太快,不利于CO2的吸收.
(3)该反应是放热反应,随着反应的进行,溶液的温度升高,盐酸具有挥发性,所以生成的二氧化碳中含有氯化氢气体,为了除去二氧化碳中的氯化氢气体又不引进新的杂质,用饱和的碳酸氢钠溶液吸收氯化氢.
故答案为:饱和的NaHCO3溶液;除去氯化氢气体.
(4)如果实验步骤②③的顺序对调,溶液中溶解了部分二氧化碳,二氧化碳和氢氧化钠反应,使氢氧化钠的量减少,混合液中碳酸氢钠和氢氧化钠的物质的量不相等,所以不能恰好完全反应生成碳酸钠,所以不对.
故答案为:不对,过量的CO2消耗NaOH,不能使NaHCO3全部转化为Na2CO3.
分析:(1)根据碳酸氢钠与氢氧化钠之间的关系分析;
(2)根据碳酸钠的性质分析;
(3)根据气体的成分及实验目的分析;
(4)二氧化碳的性质及碳酸氢钠和氢氧化钠的物质的量之间的关系分析.
点评:本题考查了钠的重要化合物的性质,要注意的是:除去二氧化碳中的氯化氢气体不能用饱和的碳酸钠溶液,虽然氯化氢和碳酸钠反应,但二氧化碳和碳酸钠反应生成,减少了二氧化碳的量,所以不用饱和的碳酸钠溶液吸收二氧化碳中的氯化氢气体.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目