题目内容
【题目】【2016届绵阳三诊】NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究。
【查阅资料】①NO不与碱反应;②亚硝酸盐除浅黄色的AgNO2难溶于水外,其余易溶于水;
③2NaNO3![]() 2NaNO2+O2↑,NaNO2热稳定性很高。
2NaNO2+O2↑,NaNO2热稳定性很高。
【实验探究Ⅰ】兴趣小组的同学经讨论设计了如下图所示实验:
(1)仪器a的名称是 ;干燥管D的作用是 。
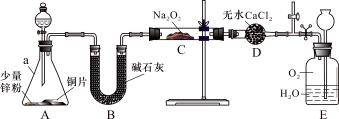
(2)从分液漏斗中加稀硝酸之前,先加入少量稀硫酸让A中锌粉完全溶解,其目的是 。
(3)若无B装置,后果是 。
(4)实验观察到C中固体颜色变白,E中气体先变红棕色,最终又变无色。E中总反应的化学方程式是 。
【实验探究Ⅱ】 该兴趣小组进一步探究C中生成的白色固体的成分。
(5)提出假设:假设1. 白色固体只有NaNO2;假设2. 白色固体只有 ;
假设3. 白色固体是两种物质的混合物。
(6)实验验证:①要证明假设2是否成立,实验操作、现象和结论是____________________。
②为证明是假设1还是假设3成立,称取C中生成的白色固体a g置于坩埚中(坩埚质量为c g),用酒精灯加热至质量不再改变,冷却后称得坩埚和剩余固体总质量为b g,假设3成立时b-c的数字范围是 。(用含a的不等式表示)
【答案】(共14分)(1)锥形瓶(1分) 防止E中的水蒸气进入C管(1分)
(2)产生H2来排出装置中的空气(2分)
(3)A中挥发出的水蒸气和硝酸蒸汽会进入C管与Na2O2反应,干扰实验(2分)
(4)4NO+3O2+2H2O==4HNO3(2分)(5)NaNO3(1分)
(6)①取C管中的固体少量于试管中溶于水,加入AgNO3溶液,若没有浅黄色沉淀,则假设2成立;若有沉淀则假设2不成立(3分,其它合理解答均给分,如使用pH试纸、酚酞溶液(试纸)、酸性KMnO4溶液等,只要操作、现象和结论正确均可)②![]() a<b-c<a(2分)
a<b-c<a(2分)
【解析】
试题分析:(1)据图像a是锥形瓶;过氧化钠易与水反应,干燥管D的作用是防止E中的水蒸气进入C管。 (2)NO在空气中不能存在,遇氧气会被氧化才二氧化氮,故先加入稀硫酸产生H2来排出装置中的空气。
(3)A中的硝酸易挥发,水蒸气和硝酸与过氧化钠反应,B中的碱石灰可以吸收硝酸和水。
(4)C中固体颜色变白,说明过氧化钠发生了反应,E中气体先变红棕色,最终又变无色是NO到二氧化氮又生成NO的过程,总反应:4NO+3O2+2H2O==4HNO3。
(5)NO可能被氧化成亚硝酸钠或硝酸钠,故假设2是白色固体只有NaNO3。
(6)①据硝酸根与亚硝酸根的区别,可以用硝酸银,取C管中的固体少量于试管中溶于水,加入AgNO3溶液,若没有浅黄色沉淀,则假设2成立;若有沉淀则假设2不成立;②若全是亚硝酸钠,则b-c=a;若全是硝酸钠,据硝酸钠分解反应2NaNO3 ==== 2NaNO2 + O2,b-c=![]() a;故
a;故![]() a<b-c<a。
a<b-c<a。