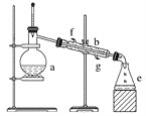
题目内容
【题目】1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为136g·cm-3。实验室制备少量1-溴丙烷的主要步骤如下:
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL 水,冰水冷却下缓慢加入28ml 浓H2SO4;冷却至室温,搅拌下加入24gNaBr。(已知:2NaBr+H2SO4(浓) ![]() Na2SO4+2HBr↑)
Na2SO4+2HBr↑)
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
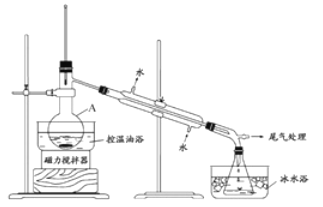
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12mLH2O、12ml5%Na2CO3溶液和12mLH2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
(1)仪器A的名称是_____________;加入搅拌磁子的目的是搅拌和_____________。
(2)反应时生成的主要有机副产物2-溴丙烷和_________________(答出一种即可给分)
(3)步骤2中需向接收瓶内加入少量冰水并置于冰水浴中的目的是________________。
(4)步骤1中浓H2SO4用水稀释,并冷却至室温后再加NaBr的目的是_____________。步骤4中用Na2CO3溶液洗涤的目的是______________________。
(5)步骤4中进一步提纯1-溴丙烷的方法是_________________;在进行此操作之前需要用无水MgBr2处理粗产品,其目的是______________________。
【答案】 蒸馏烧瓶 防暴沸或促进散热 丙烯或正丙醚 冷凝,减少1-溴丙烷的挥发 减少HBr挥发(或防止副反应的发生等合理答案均可以) 洗去1-丙醇、H2SO4等物质 蒸馏 干燥
【解析】(1)由图可知,仪器A的名称是蒸馏烧瓶,加入搅拌磁子的目的是搅拌和防止暴沸,故答案为:蒸馏烧瓶;防暴沸或促进散热;
(2)正丙醇在浓硫酸作用下可能发生消去反应,或分子间取代反应,则反应时生成的主要有机副产物有2溴丙烷和丙烯、正丙醚,故答案为:丙烯、正丙醚;
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是冷凝减少1溴丙烷的挥发,故答案为:冷凝减少1溴丙烷的挥发;
(4)步骤1中浓H2SO4温度高了会导致生成的HBr大量挥发,步骤四中Na2CO3目的是洗去1-丙醇、H2SO4等物质;
(5) 1-溴丙烷中会溶解有正丙醇,需要使用蒸馏的方法分离,
故答案为:将分液漏斗下口向上倾斜、打开活塞排出气体。无水MgBr2是一种干燥剂,在这里起干燥剂的作用。

【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式:_______________________________。
(2)实验结果表明,催化剂的催化效果与________有关。
(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是______。

Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如下图所示(A,B,C均为气体,且A气体有颜色)。

(4)该反应的的化学方程式为________________。
(5)反应开始至2分钟时,B的平均反应速率为____。
(6)下列措施能使该反应加快的是__(仅改变一个条件)。
a.降低温度 b.缩小容积c.使用效率更高更合适的催化剂
(7)能说明该反应已达到平衡状态的是___________(填序号)。
①单位时间内生成nmol B的同时生成2nmol C
②单位时间内生成nmol B的同时生成2nmol A
③容器内压强不再随时间而发生变化的状态
④用C、A、B的物质的量浓度变化表示的反应速率的比为2:2:1的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的密度不再改变的状态
⑦v逆(A)=v正(C)
(8)由图求得平衡时A的转化率为__________。