题目内容
|
以H2SO4为例,下列说法正确的是 | |
| [ ] | |
A. |
H2SO4的摩尔质量是98 |
B. |
1 mol H2SO4中含有2 mol O2 |
C. |
1.5 mol H2SO4中含有3×6.02×1023个氢原子 |
D. |
6.02×1023个H2SO4分子的质量为98 g/mol |
解析:
|
选项A,摩尔质量的单位是g/mol;选项B中应含有4 mol氧原子;选项D中质量的单位为g. |

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
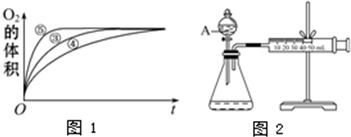
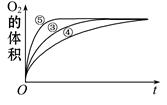
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图1.分析下图能够得出的结论是
(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如图2所示的实验装置进行实验.
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是
(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为
H2O2是实验室常用的一种化学试剂。某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。分析下图能够得出的结论是 。
(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如下图所示的实验装置进行实验。
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是 。

(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为 ;
H2O2是实验室常用的一种化学试剂。某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
|
实验编号 |
反应物 |
催化剂 |
|
① |
10mL2% H2O2溶液 |
无 |
|
② |
10mL5% H2O2溶液 |
无 |
|
③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
|
④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
|
⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)实验①和②的目的是_ ,
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。分析下图能够得出的结论是 。

(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如下图所示的实验装置进行实验。
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是 。

(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为 ;