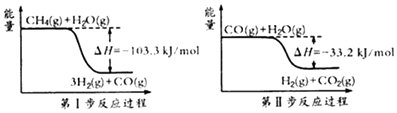
题目内容
【题目】某学习小组按如下实验流程探究海带中碘的制取。
步骤(一)
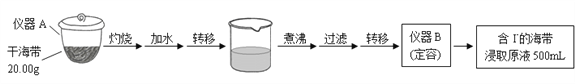
步骤(二)
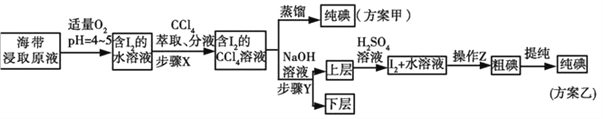
已知:①3I2+6NaOH=5NaI+NaIO3+3H2O;②常温下,碘单质微溶于水,易溶于CCl4。
请回答:
(1)步骤(一)中的仪器名称:仪器A______________, 仪器 B_______________。
(2)①分液漏斗使用前须检漏,检漏方法为__________________________。
②步骤X中,萃取后分液漏斗内观察到的现象是_______________________。
③下列有关步骤Y的说法,正确的是_______________。
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
④步骤(二)中操作Z的名称是_____________。
(3)方案甲中采用蒸馏不合理,理由是_____________________________________。
【答案】 坩埚 500mL容量瓶 关闭分液漏斗的活塞,向其中加入适量的水,检查活塞处是否漏水,倒置漏斗,观察玻璃塞处是否漏水。若都不漏,正立漏斗,将玻璃塞旋转180度后再倒置观察,若还是不漏水,则分液漏斗可以使用 液体分上下两层,上层几乎为无色,下层呈紫红色 AB 过滤 主要由于碘易升华,会导致碘的损失
【解析】(1)根据仪器构造可知仪器A是坩埚,由于后续是500mL溶液,所以仪器B是500mL容量瓶;(2)①分液漏斗捡漏的实验操作方法是:关闭分液漏斗的活塞,向其中加入适量的水,检查活塞处是否漏水,倒置漏斗,观察玻璃塞处是否漏水。若都不漏,正立漏斗,将玻璃塞旋转180度后再倒置观察,若还是不漏水,则分液漏斗可以使用;②碘易溶在四氯化碳中,且四氯化碳的密度大于水,所以步骤X中,萃取后分液漏斗内观察到的现象是液体分上下两层,上层几乎为无色,下层呈紫红色;③A.由于发生反应3I2+6NaOH=5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液,所以应控制NaOH溶液的浓度和体积,A正确;B.根据反应3I2+6NaOH=5NaI+NaIO3+3H2O可知,步骤Y将碘转化成离子进入水层,B正确;C.根据以上分析可知C错误;D.乙醇易溶于水和四氯化碳,将氢氧化钠换成乙醇,仍然无法分离出碘单质,故D错误;答案选AB;④步骤Z将碘单质和水分离,由于碘单质在水中的溶解度较小,可通过过滤操作完成;(3)方案甲中采用蒸馏操作,由于碘单质容易升华,会导致碘单质损失,所以甲方案不合理。