题目内容
【题目】写出下列化学反应方程式:
(1)乙醇催化氧化:_____;
(2)苯与浓硝酸、浓硫酸共热:_____;
(3)硬脂酸甘油脂的皂化反应:_____。
【答案】2CH3CH2OH+O2![]() 2CH3CHO+2H2O C6H6+HNO3
2CH3CHO+2H2O C6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O 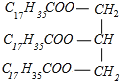 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+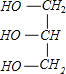 ;
;
【解析】
(1)乙醇催化氧化是乙醇在铜或银做催化剂的条件下被氧气氧化为乙醛,同时生成水,故化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(2)苯在浓硫酸的催化作用下加热能和浓硝酸发生硝化反应生成硝基苯和水,化学方程式为C6H6+HNO3![]() C6H5NO2+H2O,故答案为:C6H6+HNO3
C6H5NO2+H2O,故答案为:C6H6+HNO3![]() C6H5NO2+H2O;
C6H5NO2+H2O;
(3)硬脂酸甘油酯与氢氧化钠反应生成C17H35COONa与甘油,反应方程式为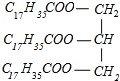 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+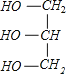 。
。

【题目】欲测定某NaOH溶液的物质的量浓度,可用0.100 0 mol·L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为________。
(2)滴定至终点的颜色变化为____________。
(3)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50 mL,滴定后液面如图,则此时消耗标准溶液的体积为__________。

(4)乙学生做了三组平行实验,数据记录如下:
实验 序号 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1 HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为______。(保留四位有效数字)
(5)下列哪些操作会使测定结果偏高________(填字母)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数







