题目内容
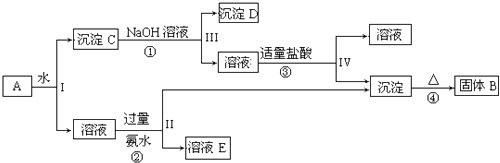
【题目】利用如图所示装置,当X,Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( ) 
A.氯碱工业中,X,Y均为石墨,X附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.电镀工业中,X是待镀金属,Y是镀层金属
D.若Z是稀硫酸,X为铜,Y为铁,则铁不溶解,该方法为外加电流的阴极保护法
【答案】D
【解析】解:A、氯碱工业上,用惰性电极电解饱和氯化钠溶液,阴极附近得到氢氧化钠,即Y附近能得到氢氧化钠,故A错误;B、铜的精炼中,粗铜作阳极X,纯铜作阴极Y,硫酸铜溶液作电解质溶液,故B错误;
C、电镀工业上,Y是待镀金属,X是镀层金属,故C错误;
D、外加电流的阴极保护法中,阴极是待保护金属,即Y铁是待保护金属不溶解,故D正确.
故选D.

【题目】聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类:主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示).
(1)一定条件下,向1.0mol/LAlCl3溶液中加入0.6mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式: .
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如表:
AlT/(molL﹣1) | Ala/% | Alb/% | A1c/% |
0.208 | 1.4 | 86.6 | 12.0 |
0.489 | 2.3 | 86.2 | 11.5 |
0.884 | 2.3 | 88.1 | 9.6 |
1.613 | 3.1 | 87.0 | 9.9 |
2.520 | 4.5 | 88.2 | 7.3 |
①在一定温度下,AlT越大,pH(填“越大”、“越小”或“不变”).
②如将AlT=2.520molL﹣1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式: .
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图1.当T>80℃时,AlT显著下降的原因是 . 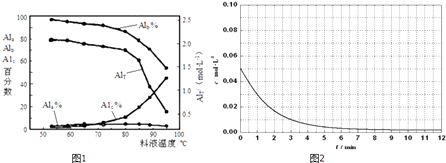
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)△H1=a kJmol﹣1
②3AlCl(g)=2Al(l)+AlCl3(g)△H2=b kJmol﹣1
则反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)△H=kJmol﹣1(用含a、b的代数式表示).反应①常压下在1900℃的高温下才能进行,说明△H0(填“>”“=”或“<”).
(4)物质中的铝元素可以通过将铝元素转化成Al3+ , 然后在水溶液中用铝试剂(NH4)3C19H11O3(COO)3(商品名为“阿罗明拿)测定,在弱酸性溶液中,Al3+可以用铝试剂反应,生成玫瑰红色的物质.随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率.用于比色分析的仪器是 .
A.pH计
B.元素分析仪
C.分光光度计
D.原子吸收光谱仪
(5)已知Al3++4X2[( ![]() X2)1.5+],X表示显色剂,
X2)1.5+],X表示显色剂, ![]() X21.5+表示有色物质,通过比色分析得到25℃时Al3+浓度随时间的变化关系如图2所示,请在同一图中绘出
X21.5+表示有色物质,通过比色分析得到25℃时Al3+浓度随时间的变化关系如图2所示,请在同一图中绘出 ![]() X21.5+浓度随时间的变化曲线 .
X21.5+浓度随时间的变化曲线 .