题目内容
6.A、B、C、D是四种短周期元素,它们的原子序数依次增大.其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示:| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
(1)丙物质的电子式为Na+[:H]-,丁物质中阴离子与阳离子的个数之比为1:2,写出丁与水反应离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑,.
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为QKJ,试写出表示甲物质燃烧热的热化学方程式CO(g)+$\frac{1}{2}$O2(g)=CO2 (g)△H=-4akJ/mol.
(3)B、C两种元素按原子个数比为1:2可形成化合物戊,A、C、D三种元素按原子个数比为1:1:1可形成化合物己,则己与戊按物质的量之比为3:2完全反应后的溶液中各离子浓度的大小关系为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
5.
分析 A、B、C、D是四种短周期元素,它们的原子序数依次增大.A、D元素同主族,二者形成原子个数1:1型离子化合物,含有金属元素,非金属元素,为ⅠA族元素,D的原子序数至少比A大3,可推知A为H、B为Na,丙为NaH;结合原子序数可知,B、C处于第二周期,B、C形成原子个数1:1的化合物甲为气体,密度略小于空气,甲应为CO,则B为碳元素;A、C形成原子个数1:1的化合物乙为液态,乙应为H2O2,则C为O元素;C、D形成原子个数1:1的离子化合物丁为Na2O2,据此解答.
解答 解:A、B、C、D是四种短周期元素,它们的原子序数依次增大.A、D元素同主族,二者形成原子个数1:1型离子化合物,含有金属元素,非金属元素,为ⅠA族元素,D的原子序数至少比A大3,可推知A为H、B为Na,丙为NaH;结合原子序数可知,B、C处于第二周期,B、C形成原子个数1:1的化合物甲为气体,密度略小于空气,甲应为CO;A、C形成原子个数1:1的化合物乙为液态,乙应为H2O2,则C为O元素;C、D形成原子个数1:1的离子化合物丁为Na2O2.
解:A、B、C、D是四种短周期元素,它们的原子序数依次增大.A、D元素同主族,二者形成原子个数1:1型离子化合物,含有金属元素,非金属元素,为ⅠA族元素,D的原子序数至少比A大3,可推知A为H、B为Na,丙为NaH;结合原子序数可知,B、C处于第二周期,A、B形成原子个数1:1的化合物甲为气体,密度略小于空气,甲应为C2H2,则B为碳元素;A、C形成原子个数1:1的化合物乙为液态,乙应为H2O2,则C为O元素;C、D形成原子个数1:1的离子化合物丁为Na2O2,
(1)丙为NaH,属于离子化合物,电子式为Na+[:H]-,丁为Na2O2,由过氧根离子与钠离子构成,阴离子与阳离子的个数比为1:2,与水反应离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:Na+[:H]-;1:2;2Na2O2+2H2O=4Na++4OH-+O2↑;
(2)标准状况下5.6LCO完全燃烧生成稳定氧化物时放出的热量为QkJ,1molCO完全燃烧放出的热量=QkJ×$\frac{1mol×22.4L/mol}{5.6L}$=4QkJ,则CO燃烧热的热化学方程式为:CO(g)+$\frac{1}{2}$O2(g)=CO2 (g)△H=-4akJ/mol,
故答案为:CO(g)+$\frac{1}{2}$O2(g)=CO2 (g)△H=-4akJ/mol;
(3)B、C两种元素按原子个数比为1:2可形成化合物戊为CO2,A、C、D三种元素按原子个数比为1:1:1可形成化合物己为NaOH,己与戊按物质的量之比为3:2完全反应后得到等物质的量Na2CO3和NaHCO3,溶液中碳酸根离子水解程度大于碳酸氢根离子,水解呈碱性,故溶液中离子浓度:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评 本题考查元素化合物推断,需要学生熟练掌握常见原子个数为1:1物质,注意燃烧热热化学方程式的书写,难度中等.

| A. | 升高温度,AgCl沉淀的溶解度减小 | |
| B. | AgCl难溶于水,溶液中没有Ag+和Cl- | |
| C. | Ag+与Cl-结合成AgCl的速率与AgCl溶解的速率相等 | |
| D. | 向AgCl饱和溶液中加入NaCl固体,AgCl沉淀的溶解度不变 |
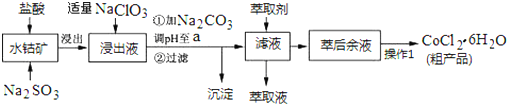
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
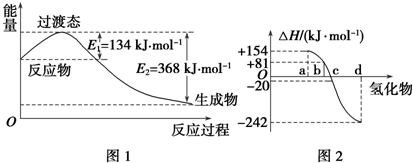
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)△H=-185kJ•mol-1
请填空:
| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 434 |
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+19kJ•mol-1③
请写出CO还原FeO的热化学方程式:CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-11 kJ•mol-1.
第一组:取刚降到地面的酸雨水样,进行了如下实验:
实验①:将一片红色的玫瑰花瓣浸在一份水样中;
实验②:向雨水试样中滴加氯化钡溶液,有白色浑浊出现;
实验③:每隔一定时间测定其pH,数据如表Ⅰ所示.
表Ⅰ不同时间酸雨的pH
| 测定时间/小时钟 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
(2)实验②中生成白色浑浊的离子方程式SO42-+Ba2+=BaSO4↓.
(3)分析实验③中pH数据的变化,你认为可能的原因是(用化学方程式表示):SO2+H2O=H2SO3、2H2SO3+O2=2H2SO4.
(4)如果取该雨水和蒸馏水混合,再测pH,结果将变大(填“变大”“变小”或“不变”).
第二组:拟用下列装置定量分析空气中SO2的含量:

(5)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的离子方程式:
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
该反应的现象是高锰酸钾溶液紫色褪去,SO2在该反应中显还原(填“氧化”或“还原”)性.
(6)该实验中已知的数据有气体流速aL/min、酸性KMnO4溶液的体积bL,其浓度为cmol/L.若从气体通入到紫色恰好褪去,用时5分钟.则此次取样处的空气中二氧化硫含量为$\frac{32bc}{a}$g/L.
| A. | 标准状况下,22.4 L CCl4中所含分子数为NA | |
| B. | 标准状况下,18g水所含原子数为NA | |
| C. | 常温常压下,11.2 LCO2所含的原子数为1.5NA | |
| D. | 常温常压下,48 g O2与O3混合物含有的氧原子数为3NA |