题目内容
【化学—选修2:化学与技术】(15分)
石膏转化为硫酸钾和CaCl2的工艺流程如下:
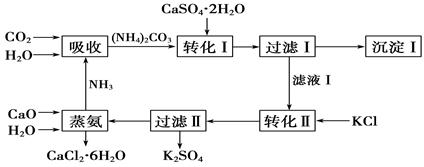
(1)CO2是一种很重要的副产品,工业上获得CO2的途径是 (用化学方程式表示)。
(2)转化Ⅰ中发生反应的离子方程式为 。过滤Ⅰ得到的滤液是 ,检验滤液中含有CO的方法是_________________________________。
(3)转化Ⅱ中发生反应的化学方程式为 ,转化Ⅱ中可获得K2SO4的原因是__________________________________________________。
(4)上述工艺流程中体现绿色化学理念的是______________________________________。
(5)氯化钙结晶水合物是目前常用的无机储热材料,选择的依据是 。
a.熔点较低(29 ℃熔化) b.能制冷
c.无毒 d.能导电
石膏转化为硫酸钾和CaCl2的工艺流程如下:

(1)CO2是一种很重要的副产品,工业上获得CO2的途径是 (用化学方程式表示)。
(2)转化Ⅰ中发生反应的离子方程式为 。过滤Ⅰ得到的滤液是 ,检验滤液中含有CO的方法是_________________________________。
(3)转化Ⅱ中发生反应的化学方程式为 ,转化Ⅱ中可获得K2SO4的原因是__________________________________________________。
(4)上述工艺流程中体现绿色化学理念的是______________________________________。
(5)氯化钙结晶水合物是目前常用的无机储热材料,选择的依据是 。
a.熔点较低(29 ℃熔化) b.能制冷
c.无毒 d.能导电
(1)CaCO3 CaO+CO2↑ (2分)
CaO+CO2↑ (2分)
(2)CaSO4+CO32-===CaCO3↓+SO42- (2分) (NH4)2SO4 (1分)
取少量滤液于试管中,滴加稀HCl,若有无色无味能使澄清石灰水变浑浊的气体产生,则证明滤液中含有CO32-,若无明显现象,则滤液中不含CO32- (2分)
(3)2KCl+(NH4)2SO4===K2SO4↓+2NH4Cl (2分)
KCl、(NH4)2SO4、K2SO4、NH4Cl四种物质的溶解度受温度的影响不同(2分)
(4)氨在工艺中循环使用、使用的原料无毒(其他合理答案也可) (2分)
(5) a c (2分)
 CaO+CO2↑ (2分)
CaO+CO2↑ (2分)(2)CaSO4+CO32-===CaCO3↓+SO42- (2分) (NH4)2SO4 (1分)
取少量滤液于试管中,滴加稀HCl,若有无色无味能使澄清石灰水变浑浊的气体产生,则证明滤液中含有CO32-,若无明显现象,则滤液中不含CO32- (2分)
(3)2KCl+(NH4)2SO4===K2SO4↓+2NH4Cl (2分)
KCl、(NH4)2SO4、K2SO4、NH4Cl四种物质的溶解度受温度的影响不同(2分)
(4)氨在工艺中循环使用、使用的原料无毒(其他合理答案也可) (2分)
(5) a c (2分)
(1)工业生产生石灰的同时会产生大量的CO2气体,这是工业上获得CO2的主要来源。
(2)碳酸钙的溶解度大于硫酸钙的,所以硫酸钙可以和碳酸盐反应生成碳酸钙。因此硫酸钙和碳酸铵反应生成碳酸钙和硫酸铵,即滤液中的主要成分是硫酸铵。碳酸盐和盐酸可以反应生成能使澄清石灰水变混浊的气体CO2,据此可以鉴别。
(3)当硫酸铵和氯化钾混合后,由于KCl、(NH4)2SO4、K2SO4、NH4Cl四种物质的溶解度受温度的影响不同,所以可以通过控制溶液的温度得到硫酸钾固体。
(4)根据转化特点可知,氨气在反应中可以循环使用,且所用的原料是无毒的。
(5)储热材料说明可以吸收热量,这说明化合物的熔点较低,易吸热熔化,从而可以较低周围环境的温度,同时化合物应该是无毒的、对人体健康没有伤害的。
(2)碳酸钙的溶解度大于硫酸钙的,所以硫酸钙可以和碳酸盐反应生成碳酸钙。因此硫酸钙和碳酸铵反应生成碳酸钙和硫酸铵,即滤液中的主要成分是硫酸铵。碳酸盐和盐酸可以反应生成能使澄清石灰水变混浊的气体CO2,据此可以鉴别。
(3)当硫酸铵和氯化钾混合后,由于KCl、(NH4)2SO4、K2SO4、NH4Cl四种物质的溶解度受温度的影响不同,所以可以通过控制溶液的温度得到硫酸钾固体。
(4)根据转化特点可知,氨气在反应中可以循环使用,且所用的原料是无毒的。
(5)储热材料说明可以吸收热量,这说明化合物的熔点较低,易吸热熔化,从而可以较低周围环境的温度,同时化合物应该是无毒的、对人体健康没有伤害的。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 C6H12O6+6O2
C6H12O6+6O2