题目内容
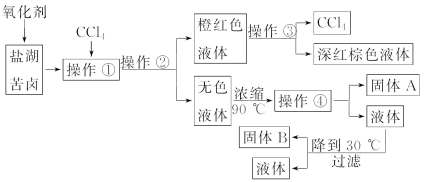
【题目】某地污水中含有Zn2+、Hg2+、Fe3+和Cu2+四种阳离子。甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下:
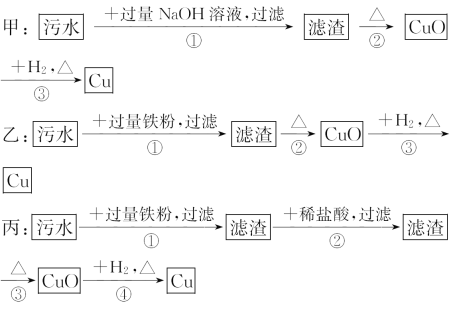
下列判断正确的是( )
A.三种实验方案中都能制得纯净的铜
B.乙方案中加过量铁粉可以将四种阳离子全部还原
C.甲方案中的反应涉及置换、分解、化合、复分解四种反应类型
D.丙方案会产生环境污染
【答案】D
【解析】选D。甲实验得到的沉淀中含有Fe(OH)3、Cu(OH)2,加热后得到Fe2O3和CuO,通H2还原后不能得到纯净的铜;乙实验中加入过量铁粉,过滤所得的滤渣中含有铁、铜等物质,最后也不能得到纯净的铜;丙实验中用盐酸溶解了滤渣中过量的铁,最后可以得到纯净的铜。因为锌比铁活泼,所以方案乙中加入的铁不能还原Zn2+。甲方案中没有涉及化合反应。丙方案有可能产生汞和酸性废水,从而导致环境污染。

练习册系列答案
相关题目