题目内容
【题目】(14分)从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是 (填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):

回答下列问题:
①在步骤i中产生的有毒气体可能有_____________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×1032,此时理论上将Al3+沉淀完全,则溶液的pH为______。
③步骤iv中,生成FeCO3的离子方程式是_______________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式 。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释 。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
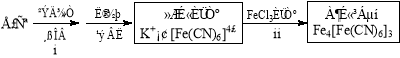
复分解反应ii的离子方程式是 。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN,方案如下:
![]()
若试纸变蓝则证明食品中含有CN,请解释检测时试纸中FeSO4的作用 。
【答案】(1)c (1分)
(2)①CO和SO2(2分) ②5(2分)
③Fe2++2HCO3==FeCO3↓+CO2↑+H2O(2分)
(3)Fe(OH)3(1分)
Fe3++3H2O![]() Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀(2分)
Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀(2分)
(4)①3[Fe(CN)6] 4+ 4Fe3+ == Fe4[Fe(CN)6]3↓(2分)
②碱性条件下,Fe2+与CN结合生成[Fe(CN)6]4;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4与Fe3+反应生成普鲁士蓝使试纸显蓝色(2分)
【解析】(1)天然磁石成分为磁铁矿,主要成分是Fe3O4,c正确。(2)①煤炭在空气中燃烧生成CO、SO2等有毒气体。②理论上当c(Al3+)≤1.0×105molL1时认为Al3+已沉淀完全,以c(Al3+)=1.0×105 molL1代入Ksp[Al(OH)3]=c(Al3+)×c3(OH)=1.0×1032,可求得c(OH)=1.0×109 molL1,则此时溶液的pH=5。③步骤iv中,根据流程图可知,反应物为HCO3和Fe2+,生成物为FeCO3,根据原子守恒判断,应有H+生成,但H+可以与HCO3继续反应生成CO2和H2O,所以整个过程离子方程式为:Fe2++2HCO3==FeCO3↓+CO2↑+H2O。(3)Cu2+和Fe3+均能水解而使溶液显酸性,但Fe3+的水解程度比Cu2+的大,Fe3+的水解反应为Fe3++3H2O ![]() Fe(OH)3+3H+,加入CuO能与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀。(4)①直接从合成方法图示可看出,[Fe(CN)6] 4与Fe3+ 反应生成Fe4[Fe(CN)6]3蓝色沉淀,离子方程式为:3[Fe(CN)6] 4+ 4Fe3+ == Fe4[Fe(CN)6]3↓。②碱性条件下,HCN转化为CN,FeSO4中的Fe2+与CN结合生成[Fe(CN)6]4;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4与Fe3+反应生成普鲁士蓝使试纸显蓝色,从而达到检测食品中CN的目的。
Fe(OH)3+3H+,加入CuO能与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀。(4)①直接从合成方法图示可看出,[Fe(CN)6] 4与Fe3+ 反应生成Fe4[Fe(CN)6]3蓝色沉淀,离子方程式为:3[Fe(CN)6] 4+ 4Fe3+ == Fe4[Fe(CN)6]3↓。②碱性条件下,HCN转化为CN,FeSO4中的Fe2+与CN结合生成[Fe(CN)6]4;Fe2+被空气中O2氧化生成Fe3+;[Fe(CN)6]4与Fe3+反应生成普鲁士蓝使试纸显蓝色,从而达到检测食品中CN的目的。




