题目内容
【题目】电子工业常用30%的FeCl3溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与金属铜发生反应的离子方程式:_________________________。
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备用如图所示步骤:
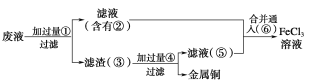
A.写出上述实验中加入或生成的有关物质的化学式:
①________;②________;③________;④________;⑤________;⑥________。
B.写出下列过程中的离子方程式:
①→②___________________________________;
⑤+⑥_______________________________________________________。
【答案】2Fe3++Cu=2Fe2++Cu2+ Fe FeCl2 Fe、Cu HCl FeCl2 Cl2 Cu2++Fe=Fe2++Cu、Fe+2Fe3+=3Fe2+ 2Fe2++Cl2=2Fe3++2Cl-
【解析】
由工艺流程可知,滤渣③中含有金属铜,目的是制取氯化铁,废液应该与过量的Fe反应,故①Fe;滤液②中含有FeCl2,通入⑥氯气可以得到氯化铁;滤渣③中含有金属Cu、未反应的Fe,加入④盐酸,过滤,回收铜,滤液⑤中含有FeCl2,据此解答。
(1)铜与氯化铁反应生成氯化铜、氯化亚铁,反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+;
(2)由工艺流程可知,滤渣③中含有金属铜,目的是制取氯化铁,废液应该与过量的Fe反应,故①Fe;滤液②中含有FeCl2,通入⑥氯气可以得到氯化铁;滤渣③中含有金属Cu、未反应的Fe,加入④盐酸,过滤,回收铜,滤液⑤中含有FeCl2,则
A.根据以上分析可知①~⑥分别是Fe、FeCl2、Fe和Cu、HCl、FeCl2、Cl2;
B.废液加入过量铁和铁离子反应生成亚铁离子,和铜离子反应生成铜,反应的离子方程式Cu2++Fe=Fe2++Cu、Fe+2Fe3+=3Fe2+;
滤液无语中含有FeCl2,通入氯气可以得到氯化铁,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案