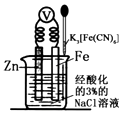
题目内容
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+ , 其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( ) 
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e﹣=4OH﹣
C.每转移0.1 mol电子,消耗标准状况下1.12 L的H2
D.OH﹣由a极通过固体酸电解质传递到b极
【答案】C
【解析】解:A、因氢元素的化合价升高,则a为负极,这样电子应该是通过外电路由a极流向b,故A错误; B、该电池为酸性电池,b极上的电极反应式为:O2+4e﹣+4H+=2H2O,故B错误;
C、每转移0.1mol电子,消耗0.05mol的H2 , 标准状况下的H2 1.12 L,故C正确;
D、原电池中,阴离子向负极移动,所以OH﹣由b极通过固体酸电解质传递到a,故D错误.
故选C.
根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化反应,反应为H2﹣2e﹣═2H+ , 通入氧气的一极为电池的正极,发生还原反应,反应为O2+4e﹣+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质溶液中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2 , 标准状况下的体积为1.12L.

 阅读快车系列答案
阅读快车系列答案【题目】表是周期表中的一部分,根据A﹣I在周期表中的位置,第(1)~(3)小题用元素符号或化学式回答,(4)~(6)小题按题目要求回答.
族 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)写出金属性最强元素与水的方应的方程式:
(2)A分别与D、E、G、形成的化合物中,稳定性由弱到强的顺序: ,
(3)F、H元素对应的最高价氧化物含氧酸由强到弱的顺序是: ,
(4)A和E组成化合物比A和F组成化合物的沸点(填“高”或“低”),原因是
(5)用电子式表示B的最高价氧化物对应的水化物的形成过程
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式