题目内容
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:

(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
(2)甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,可选用 (选填序号)。
a.KSCN溶液和氯水 b.K3Fe(CN)6溶液 c.浓氨水 d.酸性KMnO4溶液

(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
(2)甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,可选用 (选填序号)。
a.KSCN溶液和氯水 b.K3Fe(CN)6溶液 c.浓氨水 d.酸性KMnO4溶液
(10分)
(1)铁钉表面形成致密的氧化物薄膜,阻止铁和硫酸铜反应(或其他合理答案)(2分)
(2)bd(2分)
(3)检验 是否除尽(1分)
是否除尽(1分)
(4)C+2H2SO4(浓) CO2+2SO2+2H2O(2分)
CO2+2SO2+2H2O(2分)
(5)c(1分)
(6)D中固体由黑变红和E中固体由白变蓝(2分)
(1)铁钉表面形成致密的氧化物薄膜,阻止铁和硫酸铜反应(或其他合理答案)(2分)
(2)bd(2分)
(3)检验
 是否除尽(1分)
是否除尽(1分)(4)C+2H2SO4(浓)
 CO2+2SO2+2H2O(2分)
CO2+2SO2+2H2O(2分)(5)c(1分)
(6)D中固体由黑变红和E中固体由白变蓝(2分)
试题分析:(1)该操作使铁钉表面形成致密的氧化物薄膜,阻止铁和硫酸铜反应
(2)X中含有Fe3+,不能用a.KSCN溶液和氯水或c.浓氨水检验,而b.K3Fe(CN)6溶液和d.酸性KMnO4溶液能与Fe2+反应使溶液颜色发生变化,故本题选bd;
点评:对化学实验的考查是历年高考的重点,也是一个难点。解题的关键在于对实验基础知识的掌握,以及对基本实验流程的了解。实验的流程一般遵循“制备装置-除杂装置-性质检验装置-收集装置-尾气处理装置”。

练习册系列答案
相关题目

 R-Br+H2O ②
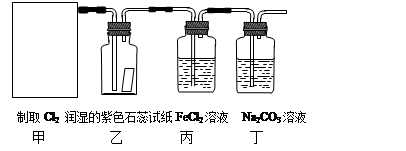
R-Br+H2O ② MnCl2 + Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
MnCl2 + Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。