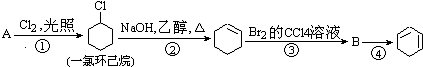
��Ŀ����
����Ŀ����������������Ҫ�ɷ�ΪFe2O3��Fe3O4��FeO��SiO2�ȣ�����������Ĺ�ҵ���������ۺ����öԻ�������������ʵ���壮���������������Ʊ�����Ȳ�Ʒ��ʵ���������£�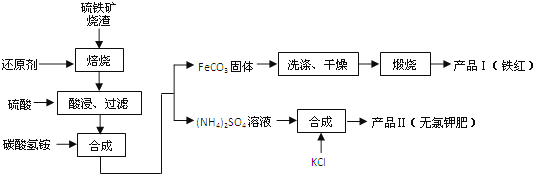
��֪�����ε��ܽ�����¶ȱ仯����������ͼ��ʾ��
�ش��������⣺
��1����������˺���Һ�еĽ����������ǡ� ��
��2������FeCO3���ɲ�ƷI�Ļ�ѧ��Ӧ����ʽΪ�� ����ʵ���ҽ������ղ��������������˾ƾ��ơ������ǡ����żܡ��������⣬���� ��
��3����Ʒ��Ļ�ѧʽΪ ��Ϊ�˻�ò�Ʒ����NH4��2SO4��Һ�м���KCl��Һ����Ҫ���еIJ����ǣ� ��
��4�������ƷII���Ƿ����Ȼ������ʵ�ʵ������ǣ�ȡ������Ʒ�����Թ��������Һ�� ��
���𰸡�Fe2+��4FeCO3+O2![]() 2Fe2O3+4CO2������������ǯ��K2SO4�������ᾧ�����ȹ��ˡ�ϴ�ӡ�����μӹ���Ba��NO3��2��Һ�����˺�����Һ�μ�AgNO3��Һ
2Fe2O3+4CO2������������ǯ��K2SO4�������ᾧ�����ȹ��ˡ�ϴ�ӡ�����μӹ���Ba��NO3��2��Һ�����˺�����Һ�μ�AgNO3��Һ
���������⣺��1����Fe2O3��Fe3O4��FeO�뻹ԭ����Ӧ������������ϡ���ᷴӦ��������������������������Һ�е���Ҫ�������������������Դ��ǣ�Fe2+��
��2����̼��������������Ӧ�������������ж�����̼��4FeCO3+O2![]() 2Fe2O3+4CO2����ʵ���ҽ������ղ������������оƾ��ơ������ǡ����żܡ�������������������ǯ��
2Fe2O3+4CO2����ʵ���ҽ������ղ������������оƾ��ơ������ǡ����żܡ�������������������ǯ��
���Դ��ǣ�4FeCO3+O2![]() 2Fe2O3+4CO2�� ����������ǯ��
2Fe2O3+4CO2�� ����������ǯ��
��3����������Ȼ��ط�Ӧ��������غ��Ȼ�泥�������ص��ܽ�����¶ȱ仯�����������ᾧ�����ȹ��ˡ�ϴ�ӡ�����õ�����أ�
���Դ��ǣ�K2SO4�������ᾧ�����ȹ��ˡ�ϴ�ӡ����
��4��������ƷII���Ƿ����Ȼ����������ȳ�ȥSO4 �� �ټ���Cl�� �� ���Եμӹ���Ba��NO3��2��Һ�����˺�����Һ�μ�AgNO3��Һ��
���Դ��ǣ��μӹ���Ba��NO3��2��Һ�����˺�����Һ�μ�AgNO3��Һ��

 ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д� �ƸԴ��ž�ϵ�д�
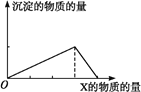
�ƸԴ��ž�ϵ�д�����Ŀ��������X����(��ͨ��)Y��Һ��,�����ɳ������������X�����ʵ����Ĺ�ϵ����ͼ��ʾ,����ͼʾ�������( )
| A | B | C | D |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A. A B. B C. C D. D
����Ŀ�������£���ijһԪ��HA��NaOH��Һ�������ϣ�������Һ��Ũ�Ⱥͻ�Ϻ�������Һ��pH�����ʾ��
ʵ���� | HA���ʵ���Ũ�ȣ�mol*L��1�� | NaOH���ʵ���Ũ�ȣ�mol*L��1�� | �����Һ��pH |
�� | 0.1 | 0.1 | pH=9 |
�� | c | 0.2 | pH=7 |
�� | 0.2 | 0.1 | pH��7 |
��ش�
��1���Ӣ������������HA�����ǿ�ᡱ�����ᡱ����
��2���������������c0.2��ѡ����ڡ�����С�ڡ����ڡ��������Һ������Ũ��c��A������c��Na+���Ĵ�С��ϵ�� ��
��3���Ӣ���ʵ����������˵��HA�ĵ���̶�NaA��ˮ��̶ȣ�ѡ����ڡ�����С�ڡ����ڡ������û����Һ������Ũ���ɴ�С��˳���� ��
��4������ʵ�����û����Һ����ˮ�������c��OH��������Һ�е�c��OH����֮��Ϊ �� д���û����Һ��������ʽ�ľ�ȷ��������ܽ��Ƽ��㣩��c��Na+����c��A����=molL��1 ��