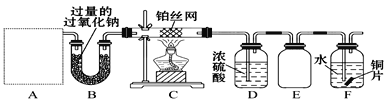
题目内容
【题目】室温下,有pH=3的盐酸、硫酸、醋酸(假设CH3COOH的电离度为1%)三种相同体积的溶液。以下叙述错误的是
A. 测定其导电性能相同
B. 与足量的锌粉反应的起始速率相同
C. 与足量的锌粉反应产生氢气的体积比为1∶1∶100
D. 与同浓度氢氧化钠溶液反应,消耗氢氧化钠溶液的体积为1∶2∶100
【答案】D
【解析】
A、pH=3的盐酸、硫酸、醋酸导电性能相同,正确;
B、pH=3的盐酸、硫酸、醋酸,锌与氢离子反应,氢离子浓度相同,起始速率相同,正确;C、HAc的电离度为1%,pH=3,c(H+)=10-3mol/L,与足量的锌粉反应,HAc均被消耗,c(HAc)=![]() mol/L=10-1mol/L,盐酸和硫酸的浓度与氢离子浓度相等,c(H+)=10-3mol/L,足量的锌粉反应产生氢气的体积比为1∶1∶100,正确;
mol/L=10-1mol/L,盐酸和硫酸的浓度与氢离子浓度相等,c(H+)=10-3mol/L,足量的锌粉反应产生氢气的体积比为1∶1∶100,正确;
D、消耗氢氧化钠溶液的体积为1∶1∶100,故D错误。
答案选D。

【题目】已知反应:2NO(g)+2H2 (g)==N2 (g)+2H2O(g) 生成N2的初始速率与NO、H2的初始浓度的关系为v=kcx( NO).cy( H2),k为速率常数。在800℃时测得的相关数据如下表所示。
实验数据 | 初始浓度 | 生成N2的初始速率/mol/(L·s) | |
c(NO)/mol/L | c(H2)/mol/L | ||
1 | 2.00×10-3 | 6.00×10-3 | 1.92×10-3 |
2 | 1.00×10-3 | 6.00×10-3 | 4.80×10-4 |
3 | 2.00×10-3 | 3.00×10-3 | 9.60×10-4 |
则下列说法中不正确的是( )
A. 当其他条件不变时,升高温度,速率常数将增大
B. 800℃时,k值为8×104
C. 若800℃时,初始浓度c(NO) =c( H2)=4.00×10-3 mol·L-l,则生成N2的初始速率为5. 12×10-3 mol/(L·s)
D. 关系式中x=l、y=2