题目内容
(14分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:______________________________________。
(2)该反应中氧化剂是________,被氧化的元素是________;若有0.5 mol H2O2参加此反应,则转移电子个数为________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为__________________;这时若有0.5 mol H2O2发生分解,则转移电子个数为________。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:______________________________________。
(2)该反应中氧化剂是________,被氧化的元素是________;若有0.5 mol H2O2参加此反应,则转移电子个数为________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为__________________;这时若有0.5 mol H2O2发生分解,则转移电子个数为________。
(1)5H2O2+2MnO4+6H+=2Mn2++5O2↑+8H2O (2)KMnO4 氧(O) 6.02×1023
(3)2H2O2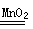 2H2O+O2↑ 3.01×1023
2H2O+O2↑ 3.01×1023
(3)2H2O2
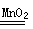 2H2O+O2↑ 3.01×1023
2H2O+O2↑ 3.01×1023(1)根据电子的得失守恒可知,氧化反应和还原反应合并后的方程式为
5H2O2+2MnO4+6H+=2Mn2++5O2↑+8H2O。
(2)氧化剂得到电子,被还原,发生还原反应,所以氧化剂是KMnO4;失去电子,化合价升高的是还原剂,所以被氧化的元素是氧;根据方程式可知,氧元素的化合价从-1价升高到0价,所以1molH2O2在反应中失去2个电子,因此转移电子是6.02×1023。
(3)H2O2分解生成氧气和水,方程式为2H2O2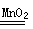 2H2O+O2↑;在反应中H2O2既是氧化剂,也是还原剂,转移1个电子,所以反应中转移的电子数是3.01×1023。
2H2O+O2↑;在反应中H2O2既是氧化剂,也是还原剂,转移1个电子,所以反应中转移的电子数是3.01×1023。
5H2O2+2MnO4+6H+=2Mn2++5O2↑+8H2O。
(2)氧化剂得到电子,被还原,发生还原反应,所以氧化剂是KMnO4;失去电子,化合价升高的是还原剂,所以被氧化的元素是氧;根据方程式可知,氧元素的化合价从-1价升高到0价,所以1molH2O2在反应中失去2个电子,因此转移电子是6.02×1023。
(3)H2O2分解生成氧气和水,方程式为2H2O2
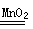 2H2O+O2↑;在反应中H2O2既是氧化剂,也是还原剂,转移1个电子,所以反应中转移的电子数是3.01×1023。
2H2O+O2↑;在反应中H2O2既是氧化剂,也是还原剂,转移1个电子,所以反应中转移的电子数是3.01×1023。
练习册系列答案
相关题目
 Al2O3 +2Fe)的实验装置,有关该反应的下列说法中正确的是
Al2O3 +2Fe)的实验装置,有关该反应的下列说法中正确的是