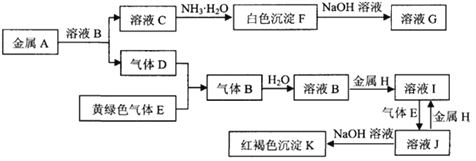
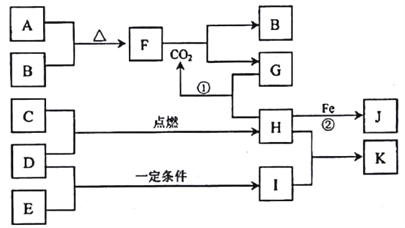
题目内容
【题目】下列属于酸性氧化物的是( )
A. Na2O B. MgO C. H2O D. CO2
【答案】D
【解析】Na2O能与酸反应生成盐和水,Na2O碱性氧化物,故A错误;MgO能与酸反应生成盐和水, MgO是碱性氧化物,故B错误;H2O和酸碱都不反应,是不成盐氧化物,故C错误;CO2能与碱反应生成盐和水,CO2是酸性氧化物,故D正确。

 金牌教辅培优优选卷期末冲刺100分系列答案
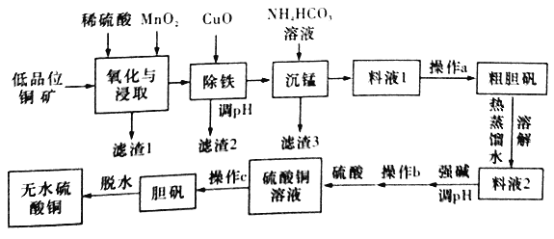
金牌教辅培优优选卷期末冲刺100分系列答案【题目】无水硫酸铜是一种重要的化学试剂,工业上用低品位钢矿(合CuS、Cu2S、CuO,以及FeO、Fe2O3、SiO2等杂质)制备无水硫酸铜的流程如下图所示:
(NH4)2SO4、CuSO4的溶解度(g)部分数据如下表所示:
温度 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
S(CuSO4)/g | 17 | 20.7 | 24.4 | 28.5 | 33.6 | 40 | 77 |
S[(NH4)SO4]/g | 73 | 75.4 | 78.1 | 81.0 | 84.5 | 87.8 | 102 |
(1)氧化与浸取过程中发生的反应之一为Cu2S被MnO2氧化时有一种非全属单质生成,则该反应的离子方程式为____________,滤渣1的主要成分是__________(填化学式),除铁时加入CuO能得到滤渣2的原理是__________________。
(2)除铁后,为了判断滤液中是否有Fe3+残留,请设计实验方案:__________。
(3)沉锰时还有一种酸性气体生成,则沉锰时发生反应的离子方程式为___________。(已知pH=8.8时,Mn2+开始沉淀)。
(4)为了从料液1中尽可能多地析出粗胆矾,操作a的内容是__________(填名称)。
(5)工业上利用上述原理制备胆矾。已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=8.0×10-38。离子浓度小于1×10-5mol/L时表明该离子已完全沉淀。常温下,若某溶液中c(Cu2+)=2.2 mol/L,c(Fe3+)=O.001mol/L,加入氧化铜除铁时,调节溶液pH范围为________(lg5=0.7)。