题目内容
(9分)恒温下,将a mol N2和b mol H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.92倍,试求:
(1)反应前混合气体中N2和H2的体积比a﹕b=__________;
(2)达到平衡时混合气体中的H2、NH3的物质的量分别是_____mol、 mol;
(本小题请给推算过程)
(3)平衡时N2的转化率[n转化(N2)与n初始(N2)之比]________________。
(1)反应前混合气体中N2和H2的体积比a﹕b=__________;
(2)达到平衡时混合气体中的H2、NH3的物质的量分别是_____mol、 mol;
(本小题请给推算过程)
(3)平衡时N2的转化率[n转化(N2)与n初始(N2)之比]________________。
(1)1:4(2分)
(2)3.4、0.4
(3)20%(2分)
(2)3.4、0.4
(3)20%(2分)
(1)1:4(2分)
(2)3.4、0.4
推算过程:设达平衡时转化的N2的物质的量为x
N2 + 3H2
 2NH3
2NH3起始/mol 1 4 0
转化/mol x 3x 2x
平衡/mol 1-x 4-3x 2x
依题意有
 ,得x=0.2
,得x=0.2n(H2)= 4-3x="3.4 " n(NH3)=2x=0.4(结果2分,过程3分,其他计算过程合理也给分)
(3)20%(2分)

练习册系列答案
相关题目
 ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。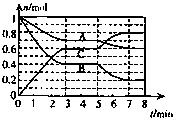
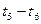
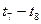
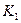
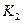
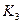
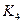
 CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表:
CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表: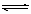 c W(气)+d Z(气),若反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,再次达到平衡时,Z的浓度是原平衡的1.8倍,下列叙述中正确的是
c W(气)+d Z(气),若反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,再次达到平衡时,Z的浓度是原平衡的1.8倍,下列叙述中正确的是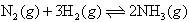 ,下列说法中,表明这一反应已达到化学平衡状态的是
,下列说法中,表明这一反应已达到化学平衡状态的是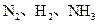 的浓度相等
的浓度相等  CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是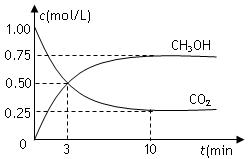
 2X(g)+Y(g)
2X(g)+Y(g) 3R(g),该反应经2s后达到平衡,测得R气体的浓度为0.6mol/L。下列说法中错误的是( )
3R(g),该反应经2s后达到平衡,测得R气体的浓度为0.6mol/L。下列说法中错误的是( ) 3C(气), 在一定的条件下, 使一定量A和B气体反应, 达到平衡状态时, 具有的性质是( )
3C(气), 在一定的条件下, 使一定量A和B气体反应, 达到平衡状态时, 具有的性质是( )