题目内容
5.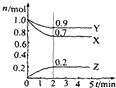 某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.由图中所给数据进行分析:
某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.由图中所给数据进行分析:(1)该反应的化学方程式为3X+Y?2Z;
(2)反应从开始至2分钟末,用Z表示该反应的平均反应速率0.05mol.L-1.min-1;
(3)反应达平衡时X的转化率:30%.
分析 (1)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
(2)根据v=$\frac{△c}{△t}$进行计算;
(3)转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:(1)由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,
当反应进行到2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,
则△n(X):△n(Y):△n(Z)=3:1:2,参加反应的物质的物质的量之比等于化学计量数之比,
则反应的方程式为:3X+Y?2Z,
故答案为:3X+Y=2Z;
(2)反应开始至2min末,Z的反应速率为:v=$\frac{△c}{△t}$=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),
故答案为:0.05mol.L-1.min-1;
(3)反应达平衡时X的转化率=$\frac{1.0mol-0.7mol}{1.0mol}$×100%=30%,
故答案为:30%.
点评 本题考查化学反应速率图象题目,题目难度不大.把握化学反应速率的定义和化学反应速率之比等化学计量数之比为解答的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列试剂中可用于鉴别Fe2+和Fe3+的是( )
①NaOH溶液 ②酸性KMnO4溶液 ③KSCN溶液 ④Fe粉.
①NaOH溶液 ②酸性KMnO4溶液 ③KSCN溶液 ④Fe粉.
| A. | ①③ | B. | ①②③ | C. | ①③④ | D. | ①②③④ |
16.关于卤代烃的说法正确的是( )
| A. | 卤素原子是卤代烃的官能团.C-X之间的共用电子对偏向卤原子,形成一个极性较强的共价键,分子中C-X键易断裂 | |
| B. | 卤代烃难溶于水,易溶于大多数有机溶剂,常温下均呈液态,且密度均>1 g/cm3 | |
| C. | 强碱的水溶液中均可发生水解反应;在强碱的醇溶液中加热均可发生消去反应 | |
| D. | 卤素原子的检验步骤:①取少量卤代烃;②加入NaOH溶液;③加热煮沸;④冷却;⑤加入硝酸银溶液 |
17.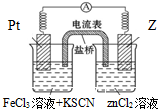 298K时,在FeCl3溶液中加少量锌粒后,Fe3+被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
298K时,在FeCl3溶液中加少量锌粒后,Fe3+被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
 298K时,在FeCl3溶液中加少量锌粒后,Fe3+被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
298K时,在FeCl3溶液中加少量锌粒后,Fe3+被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )| A. | 正极电极反应为Zn-2e-═Zn2+ | |
| B. | 左边烧杯中溶液的红色变浅 | |
| C. | Pt电极上有气泡出现 | |
| D. | 该电池的总反应为:3Zn+2Fe3+═3Zn2++2 Fe |
14.如图是对物质的一种分类方法,该分类法的名称及序号①~⑥代表的物质可以是( )
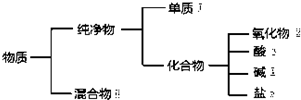

| A. | 交叉分类法 ①硫磺 ②氯水 ④小苏打 ⑥青铜 | |
| B. | 树状分类法 ①白磷 ④纯碱 ⑤水玻璃 ⑥水泥 | |
| C. | 交叉分类法 ②硅石 ③氢氟酸 ⑤纯碱 ⑥漂白粉 | |
| D. | 树状分类法 ②冰水 ④烧碱 ⑤胆矾 ⑥氨水 |
 ;
; 分子中含氧官能团的名称是醛基;该有机物发生加聚反应后,所得产物的结构简式为
分子中含氧官能团的名称是醛基;该有机物发生加聚反应后,所得产物的结构简式为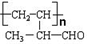 .
.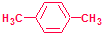 ,该烃在光照下生成的一氯代物在PMR谱中可能产生的各组信号峰的峰面积之比为3:2:2:2.
,该烃在光照下生成的一氯代物在PMR谱中可能产生的各组信号峰的峰面积之比为3:2:2:2.