题目内容
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5,反应AX3(g)+X2(g)AX5(g)在容积为10L的密闭容器中进行。起始时AX3和X2均为0.2mol,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。回答下列问题:
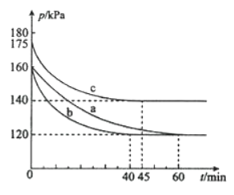
(1)计算实验a反应开始至达到平衡时的反应速率v(AX5)=________;
(2)图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为_______(填实验序号);与实验a相比,其他两组改变的实验条件是:b___________,c____________。
(3)用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为________;实验a的平衡转化率:αa为________。
【答案】1.7×10—4mol/(L·min) bca 加入催化剂 升高温度 ![]() 50%
50%
【解析】
(1)根据压强之比是物质的量之比结合v=△c/△t计算;
(2)计算平衡时的反应速率,然后比较反应速率大小;根据图像曲线变化特点结合外界条件对反应速率和平衡状态的影响分析解答;
(3)根据三段式计算。
(1)起始时AX3和X2均为0.2mol,总压强为160KPa,平衡时总压强为120kPa,设平衡时总物质的量为n,根据压强之比就等于物质的量之比有:120kPa/160kPa=n/0.4mol,解得n=0.30mol,则
AX3(g) + X2(g)AX5(g)
起始量(mol) 0.2 0.2 0
转化量(mol) x x x
平衡量(mol) 0.2-x 0.2-x x
则(0.20-x)+(0.20-x)+x=0.30
解得x=0.10
所以v(AX5)=0.10mol/(10L×60min)=1.7×10—4mol/(L·min);
(2)由以上分析可知到达平衡时生成AX5的量为0.10mol。实验b从反应开始至达到平衡时所用时间为40 min,其反应速率v(AX5)=0.10mol/(10L×40min)=2.5×10-4mol/(L·min);同理可算出,实验c达到平衡时,v(AX5)=1.8×10-4mol/(L·min),故速率v(AX5)由大到小的顺序是bca;与实验a相比较,实验b达到平衡的时间短,但平衡点与实验a相同,改变条件应为加入催化剂,从而导致反应速率加快;实验c与实验a比较,起始时容器的体积和气体的物质的量均相同,但压强增大,改变条件应为升高温度使气体膨胀所致。
(3) AX3(g) + X2(g)AX5(g)
起始量(mol) 0.2 0.2 0
转化量(mol) 0.2α 0.2α 0.2α
平衡量(mol) (0.2-0.2α) (0.2-0.2α) 0.2α
则有0.4/(0.4-0.2α)=p0/p,解得α=![]() 。实验a平衡时p0、p分别是160、120,则平衡转化率αa=50%。
。实验a平衡时p0、p分别是160、120,则平衡转化率αa=50%。

【题目】下表实验、现象和结论均正确的是
选项 | 实验 | 现象 | 结论 |
A | 向浓度均为0.lmol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
B | 向某溶液中滴加足量稀硫酸 | 溶液中出现了气泡和淡黄色浑浊 | 溶液中可能含有S2O32- |
C | 常温下,用pH试纸测定等物质的量浓度的NaCN和NaClO溶液pH | 前者的 pH比后者的大 | 水解程度:CN-<ClO- |
D | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体(已知FeCl3 +KSCN | 溶液颜色变浅 | 平衡向逆反应方向移动 |
A. A B. B C. C D. D
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得0.1mol/L的Na2SO3溶液pH=11,其原因是___________(用离子方程式解释)
(2)调节pH,对两者的反应进行了如下实验并记录了实验现象(实验都在锥形瓶中完成,且所用锥形瓶均进行振荡)
实验 | pH | 实验现象 |
1 | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
2 | 6 | 产生白色沉淀,放置长时间后无变化 |
3 | 2 | 产生白色沉淀,一段时间后,变为棕黑色海绵状沉淀X |
已知:
A.Ag2SO3:白色不溶于水,能溶于过量Na2SO3溶液
B.Ag2SO4:白色微溶于水,只能溶于浓硝酸
C.Ag2O:棕黑色,能与酸反应
①根据以上信息,解释实验1中白色沉淀溶解可能的原因___________
②甲同学对于实验2中的白色沉淀的成分,提出如下猜想
猜想1:白色沉淀为Ag2SO3
猜想2:白色沉淀为Ag2SO4
猜想3:白色沉淀中既有Ag2SO3也有Ag2SO4
为了证明其猜想,甲同学过滤实验2中的白色沉淀,加入_________溶液,发现白色沉淀部分溶解;再将剩余固体过滤出来,加入_________溶液,沉淀完全溶解,由此证明猜想3成立。
(3)乙同学为了确定实验3中棕黑色沉淀X的成分,做了如下实验
①向X中加入稀盐酸,无明显变化
②向X中加入过量浓硝酸,有红棕色气体生成
③分别用Ba(NO3)2溶液和BaCl2溶液检验实验②反应后的溶液,发现前者无变化,后者产生白色沉淀,其中,实验①的目的为___________,由上述实验现象可确定沉淀X的成分为___________(填化学式),实验②的化学方程式为___________。