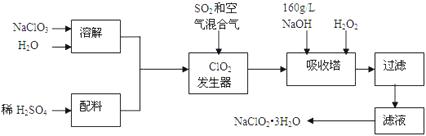
题目内容
【题目】表 列出了A~R十种元素在周期表的位置:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | E | R | F | |||||
3 | A | C | D | H | I | G | ||
4 | B |
(1)在所示十种元素中,最活泼的金属元素是 . (均填元素符号)
(2)在所示十种元素中,原子半径最小的是 , 原子半径最大的是.(均填元素符号)
(3)C元素在周期表中的位置: .
(4)写出EF2分子的电子式 .
(5)H,I,G三种元素的氧化物对应的水化物中酸性由大到小的顺序排列为 . (填化学式).
(6)写出G的单质与A的最高价氧化物对应水化物反应的离子方程式 .
(7)E单质和R的最高价氧化物对应水化物相互反应的化学方程式 .
【答案】
(1)K
(2)O;O
(3)第三周期IIA族
(4)![]()
(5)HClO4>H2SO4>H2SiO3
(6)Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
(7)C+4HNO3(浓) ![]() ?4NO2↑+CO2↑+2 H2O
?4NO2↑+CO2↑+2 H2O
【解析】解:由元素在周期表中的位置可知,A为Na,B为钾,C为Mg,D为Al,E为碳,H为Si,R为氮,F为氧,I为硫,G为Cl.(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故上述元素中最活泼的金属元素是K,所以答案是:K;(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,一般电子层越多原子半径越大,上述元素中,原子半径最小的是O,原子半径最大的是K,所以答案是:O;K;(3)由C的位置可知,处于周期表中第三周期IIA族,所以答案是:第三周期IIA族;(4)EF2为CO2 , 分子中C原子与氧原子之间形成2对共用电子对,电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(5)同周期自左而右非金属性增强,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性:HClO4>H2SO4>H2SiO3 , 所以答案是:HClO4>H2SO4>H2SiO3;(6)氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;(7)碳与浓硝酸反应生成二氧化碳、二氧化氮与水,反应方程式为:C+4HNO3(浓)
;(5)同周期自左而右非金属性增强,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性:HClO4>H2SO4>H2SiO3 , 所以答案是:HClO4>H2SO4>H2SiO3;(6)氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;(7)碳与浓硝酸反应生成二氧化碳、二氧化氮与水,反应方程式为:C+4HNO3(浓) ![]() 4NO2↑+CO2↑+2 H2O, 所以答案是:C+4HNO3(浓)
4NO2↑+CO2↑+2 H2O, 所以答案是:C+4HNO3(浓) ![]() 4NO2↑+CO2↑+2 H2O.
4NO2↑+CO2↑+2 H2O.