题目内容
【题目】(1)下列物质中:A.KI(s) B.C2H5OH(l) C.Cl2(g) D.CH3COOH(l) E.BaSO4(s) F.NaHSO4(s) G.石墨(s) H.蔗糖(s) I.NaOH(l)
属于非电解质的是_________,属于强电解质的是_________,能直接导电的是____________________,能溶于水,且水溶液能导电的是________________。
(2)将6g CH3COOH溶于水制成1L溶液,此溶液的物质的量浓度为________,经测定溶液中含CH3COO-为1.4×10-3mol/L,此温度下醋酸的电离常数:Ka=____________,温度升高Ka将____________(填“变大”、“不变”或“变小”)。
(3)Al(OH)3的电离方程式可表示为:H++AlO![]() +H2O
+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
a、向Al(OH)3沉淀中加入盐酸,沉淀溶解,其原因是_______________________,有关的离子方程式为________________________________。
b、向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是_____________________,有关的离子方程式为____________________________________。
【答案】 B、H AEFI GI ACDFI 0.1mol·L-1 1.99×10-5 变大 盐酸中的H+与OH-结合生成水,使上述平衡中c(OH-)减小,平衡向右移动,Al(OH)3沉淀不断溶解 Al(OH)3+3H+===Al3++3H2O 苛性钠溶液中OH-结合H+生成水,使上述平衡中c(H+)减小,平衡向左移动,Al(OH)3沉淀不断溶解 Al(OH)3+OH-===AlO![]() +2H2O
+2H2O
【解析】(1)溶于水和在熔融状态下均不能电离出离子的化合物是非电解质,因此属于非电解质的是乙醇、蔗糖;完全电离出离子的电解质是强电解质,则属于强电解质的是碘化钾、硫酸钡、硫酸氢钠、氢氧化钠;能直接导电的是石墨和熔融的氢氧化钠,能溶于水,且水溶液能导电的是碘化钾、氯气、醋酸、硫酸氢钠 氢氧化钠。
(2)将6g CH3COOH溶于水制成1L溶液,醋酸的物质的量是6g÷60g/mol=0.1mol,此溶液的物质的量浓度为0.1mol÷1L=0.1mol/L,经测定溶液中含CH3COO-为1.4×10-3mol/L,此温度下醋酸的电离常数:Ka=![]() ,温度升高促进电离,因此Ka将变大。(3)a、由于盐酸中的H+与OH-结合生成水,使上述平衡中c(OH-)减小,平衡向右移动,因此Al(OH)3沉淀不断溶解,有关的离子方程式为Al(OH)3+3H+===Al3++3H2O。b、由于苛性钠溶液中OH-结合H+生成水,使上述平衡中c(H+)减小,平衡向左移动,因此Al(OH)3沉淀不断溶解,有关的离子方程式为Al(OH)3+OH-===AlO2-+2H2O。
,温度升高促进电离,因此Ka将变大。(3)a、由于盐酸中的H+与OH-结合生成水,使上述平衡中c(OH-)减小,平衡向右移动,因此Al(OH)3沉淀不断溶解,有关的离子方程式为Al(OH)3+3H+===Al3++3H2O。b、由于苛性钠溶液中OH-结合H+生成水,使上述平衡中c(H+)减小,平衡向左移动,因此Al(OH)3沉淀不断溶解,有关的离子方程式为Al(OH)3+OH-===AlO2-+2H2O。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
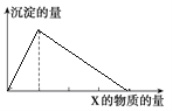
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A. A B. B C. C D. D