题目内容
6.体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2 只发生了如下过程:H2O2→O2.(1)该反应应选择的酸是:C(填序号).
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸.
(2)该反应中发生还原反应的过程是:MnO4-→Mn2+.
(3)写出该反应配平的离子方程式:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑.
(4)如果上述反应中有6.72L(标准状况)气体生成,转移的电子为0.6mol.
(5)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑(已配平),该反应中的还原剂是KSCN.生成物A的化学式为KHCO3,H2O2被称为绿色氧化剂的理由是H2O2是氧化剂,其产物是H2O,H2O没有毒性及污染性.
分析 (1)高锰酸根时强氧化性的离子,能将盐酸、醋酸等氧化;
(2)化合价降低元素在反应中被还原发生还原反应;
(3)根据氧化还原反应中氧化剂和还原剂的特点和性质来寻找反应物和生成物,然后结合化合价升降相等配平;
(4)根据离子方程式和电子转移情况进行计算;
(5)化学方程式遵循原子守恒;根据化合价变化判断该反应的还原剂;H2O2是氧化剂的产物是H2O,没有毒性及污染性.
解答 解:(1)该反应为MnO4-酸性环境下氧化H2O2的反应,
A.盐酸中氯离子也会被酸性MnO4-氧化,故A错误;
B.浓硫酸没有必要,这里主要利用硫酸的酸性就可以了,不需要浓硫酸,故B错误;
C.稀硫酸可以提供酸性环境并且不易被高锰酸根氧化,故C正确;
D.醋酸酸性弱,还可能被MnO4-氧化,故D错误;
故答案为:C;
(2)该反应过程中,MnO4-的Mn元素化合价降低,在反应中被还原生成Mn2+,发生还原反应,
故答案为:MnO4-;Mn2+;
(3)该反应过程中,高锰酸根的氧化性和双氧水的还原性导致二者间发生氧化还原反应,高锰酸根离子中锰元素从+7变为+2价,化合价降低5价,双氧水中氧元素化合价从-1价变为0价,化合价至少升高2价,则高锰酸根离子的系数为2,双氧水的系数为5,然后利用质量守恒配平可得该反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;
(4)上述反应中生成5mol氧气转移电子10mol,当反应中有6.72L(标准状况)即0.3mol氧气生成时,则转移的电子为:10mol×$\frac{0.3mol}{5}$=0.6mol,
故答案为:0.6;
(5)反应KCN+H2O2+H2O═A+NH3↑中,根据原子守恒可知生成物A的化学式为KHCO3;
该反应中KSCN中C元素化合价升高被氧化,所以还原剂为KSCN;
H2O2是氧化剂,其产物是H2O,H2O没有毒性及污染性,所以H2O2被称为绿色氧化剂,
故答案为:KSCN;KHCO3;H2O2是氧化剂,其产物是H2O,H2O没有毒性及污染性.
点评 本题考查了氧化还原反应的配平及综合应用,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力,注意掌握氧化还原反应的配平方法,明确氧化剂、还原剂的概念及判断方法.

| A. | 淀粉溶液(NaCl):渗析 | |
| B. | 乙醇(乙酸):加NaOH溶液,分液 | |
| C. | 乙醛溶液(乙酸):加NaOH溶液,蒸馏 | |
| D. | 肥皂液(甘油):加食盐搅拌、盐析、过滤 |
①制备氢气的简易装置中加入稀硫酸的长颈漏斗
②制备氯气装置中的分液漏斗
③用新制的FeSO4溶液和NaOH溶液制备Fe(OH)2操作中的胶头滴管
④将氯气溶于水时制取氯水的导气管
⑤蒸馏石油时的温度计.
| A. | ①③ | B. | ②④⑤ | C. | ①③④ | D. | 全部 |
| A. | 碳酸钠(s) | B. | 醋酸钠(s) | C. | 硫酸钠(aq) | D. | 硫酸钾(s) |
| A. | 标准状况下,11.2 L三氧化硫所含有的原子数目为2NA | |
| B. | 分解H2O2制O2,每生成1mol O2转移2NA个电子 | |
| C. | 62 g Na2O溶于水后所得溶液中含有O2-数为NA | |
| D. | 36.5 g HCl中含有Cl-数为NA |
| A. | K+、Cl-、NO3-、S2- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | K+、Fe2+、I-、SO42- | D. | Na+、Ca2+、Cl-、HCO3- |

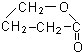 +2H2O.
+2H2O.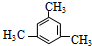 ;.
;.