题目内容
【题目】按要求填空
催化剂能改变化学反应的速率,原因是改变化学反应的路径.某同学在实验中发现,向2mL5%H2O2溶液中分别滴入FeCl3和FeCl2溶液,都立即产生大量气泡;向反应后的溶液中滴入几滴KSCN溶液,溶液均变为红色.查阅资料知:FeCl3在H2O2分解中发生如下反应:
①2Fe3++H2O2═2Fe2++2H++O2↑ ②2Fe2++2H++H2O2═2Fe3++2H2O
(1)在反应①中Fe3+作;在反应②中Fe3+是 . 有同学认为Fe2+也可作H2O2分解的催化剂,你认为该观点是否正确,并简述理由
.
(2)反应2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,加入少许MnSO4固体能明显观察到溶液紫色褪去时间变短.在试管中加入4mL0.01mol/LKMnO4酸性溶液和2mL0.1mol/LH2C2O4溶液,实验初始阶段时间﹣速率图象合理的是图1中的(填序号). 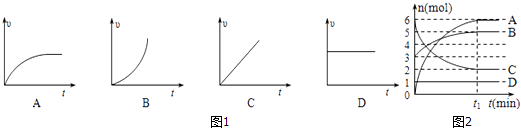
(3)某反应体系中存在A、B、C、D四种物质,反应过程中各物质的物质的量变化如图2所示,请写出该反应的化学方程式 .
(4)焙烧明矾产生的SO2可用于制硫酸.已知25℃、101kPa时:
2SO2(g)+O2(g)═2SO3(g)△H1=﹣197kJmol﹣1;
H2O(g)═H2O(l)△H2=﹣44kJmol﹣1;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=﹣545kJmol﹣1 .
则SO3(g)与H2O(l)反应的热化学方程式是 .
【答案】
(1)氧化剂;氧化产物;正确;Fe2+先被H2O2氧化:2Fe2++2H++H2O2═2Fe3++2H2O,再发生反应:2Fe3++H2O2═2Fe2++2H++O2↑,总反应为:2H2O2 ![]() 2H2O+O2↑,在反应前后Fe2+性质和质量不变,Fe2+作H2O2分解的催化剂
2H2O+O2↑,在反应前后Fe2+性质和质量不变,Fe2+作H2O2分解的催化剂
(2)B
(3)2C?3A+B
(4)SO3(g)+H2O(l)=H2SO4(l)△H=﹣130kJ/mol
【解析】解:(1)Fe3+化合价降低,得到电子做氧化剂,Fe2+化合价升高被氧化得到Fe3+ , Fe3+是氧化产物;Fe2+先被H2O2氧化:2Fe2++2H++H2O2═2Fe3++2H2O,再发生反应:2Fe3++H2O2═2Fe2++2H++O2↑,总反应为:2H2O2 ![]() 2H2O+O2↑,在反应前后Fe2+性质和质量不变,Fe2+作H2O2分解的催化剂,
2H2O+O2↑,在反应前后Fe2+性质和质量不变,Fe2+作H2O2分解的催化剂,
所以答案是:氧化剂;氧化产物;正确;Fe2+先被H2O2氧化:2Fe2++2H++H2O2═2Fe3++2H2O,再发生反应:2Fe3++H2O2═2Fe2++2H++O2↑,总反应为:2H2O2 ![]() 2H2O+O2↑,在反应前后Fe2+性质和质量不变,Fe2+作H2O2分解的催化剂;
2H2O+O2↑,在反应前后Fe2+性质和质量不变,Fe2+作H2O2分解的催化剂;
(2.)加入少许MnSO4固体能明显观察到溶液紫色褪去时间变,说明Mn2+对该反应有催化作用,则实验开始反应速率慢,当生成的Mn2+越来越多,反应速率加快,只有B符合先慢后快,
所以答案是:B;
(3.)反应物物质的量减少,生成物物质的量增加,最终各物质的量不再变化,该反应是可逆反应,则C是反应物,A、B是生成物,D一直没变,没有参加反应,根据相同时间A、B、C变化量之比为4:6:2,则各物质计量数之比为2:3:1,方程式为2C3A+B,
所以答案是:2C3A+B;
(4.)2SO2(g)+O2(g)=2SO3(g)△H1=一197kJ/mol ①
H2O (g)=H2O(1)△H2=﹣44kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③﹣①﹣②×2)× ![]() 得SO3 (g)+H2O(l)=H2SO4(l)△H=﹣130kJ/mol,所以答案是:SO3(g)+H2O(l)=H2SO4(l)△H=﹣130kJ/mol.
得SO3 (g)+H2O(l)=H2SO4(l)△H=﹣130kJ/mol,所以答案是:SO3(g)+H2O(l)=H2SO4(l)△H=﹣130kJ/mol.

 精英口算卡系列答案
精英口算卡系列答案