题目内容
【题目】废旧钴金属片中的钴有+2 价和+3 价,还含有锰、铁、钙、镁、铝等金属元素及碳粉等,回 收钴的工艺流程:
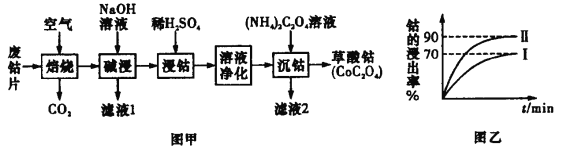
已知:①焙烧后 Mn 元素的化合价为+2
②
物质 | MgF2 | CaF2 | CoF2 | MgC2O4 | CaC2O4 | CoC2O4 |
溶度积 | 4×10-9 | 5.3×10-9 | 4×10-3 | 5×10-6 | 6.4×10-9 | 1.7×10-7 |
(1)焙烧时为了使废旧钴金属片充分反应,可采取的措施是_____________(任写一条)。
(2)滤液 1 含有的阴离子是 ____________ 。
(3)该流程中浸钴时,钴的浸出率最高只能达到 70%,后来改进方法,加入使用硫酸进行第一次浸取后, 再加入 Na2SO3 溶液进行第二次浸取,从而使钴的浸出率达 90%以上,写出第二次浸出钴时溶液中发生反 应的离子方程式:___________________
(4)净化溶液的操作中含有多个步骤,先除铁后除锰。
①除铁:常温下,调节溶液 pH 为 1.5~2.0 后,加 H2O2,反应一段时间,加 8%Na2CO3 溶液,将溶液 的 pH 调至 4.0~5.0。请用化学平衡移动原理解释加入 Na2CO3 溶液能除去溶液中铁元素的原因____________。
②除锰:加入 NaClO 溶液。写出该离子方程式:___________________。
③减钙镁:加入 NH4F 溶液,沉淀大部分的钙、镁的离子。 试解释为何草酸铵溶液沉钴前要减钙镁:_____。
(5)树德中学化学兴趣小组欲探究 CoC2O42H2O 受热后的分解产物,取 5.49gCoC2O42H2O(摩尔质量为183g/mol)于硬质玻璃管中加热一段时间,冷却、称量,剩余氧化物固体的质量为 2.41g。书写 CoC2O42H2O受热分解的化学方程式___________________________________。
【答案】将废旧钴片粉碎或适当增大空气的进气量 AlO2-、OH- ![]() 或
或![]() 溶液中存在铁离子的水解平衡:
溶液中存在铁离子的水解平衡:![]() ,向该体系中加入Na2CO3溶液后,CO32-和H+反应,使c(H+)降低,促进水解平衡正向移动,生成Fe(OH)3沉淀
,向该体系中加入Na2CO3溶液后,CO32-和H+反应,使c(H+)降低,促进水解平衡正向移动,生成Fe(OH)3沉淀 ![]() 草酸钴的溶度积比草酸钙大,与草酸镁很接近,先减少钙、镁离子的浓度,可以避免再沉钴时引入钙、镁杂质
草酸钴的溶度积比草酸钙大,与草酸镁很接近,先减少钙、镁离子的浓度,可以避免再沉钴时引入钙、镁杂质 ![]()
【解析】
由流程图可知,废钴片在空气中焙烧后,生成钴、锰、铁的氧化物以及氧化镁、氧化铝、氧化钙、二氧化碳等,加入氢氧化钠溶液碱浸可以与氧化铝反应生成偏铝酸钠,从而过滤除去,然后再用稀硫酸浸取钴元素,使其转化为离子,同时锰、铁、钙、镁元素也转化为相应的离子,再经过溶液净化除去铁、锰、钙、镁,最后用草酸铵溶液沉淀钴离子,得到草酸钴,据此分析解答。
(1)将废旧钴片粉碎或适当增大空气的进气量,可以在焙烧时使废旧钴金属片充分反应,故答案为:将废旧钴片粉碎或适当增大空气的进气量;
(2)加入氢氧化钠溶液碱浸,Al2O3与氢氧化钠反应生成偏铝酸钠,则滤液 1 的溶质为偏铝酸钠和过量的氢氧化钠,则含有的阴离子是AlO2-、OH-,故答案为:AlO2-、OH-;
(3)Na2SO3具有还原性,可以将+3价钴的氧化物还原为+2价钴离子,发生反应的离子方程式为![]() 或
或![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
(4)①加H2O2,可以将Fe2+氧化为Fe3+,在溶液中存在铁离子的水解平衡:![]() ,则向该体系中加入Na2CO3溶液后,CO32-和H+反应,使c(H+)降低,促进水解平衡正向移动,生成Fe(OH)3沉淀,故答案为:溶液中存在铁离子的水解平衡:
,则向该体系中加入Na2CO3溶液后,CO32-和H+反应,使c(H+)降低,促进水解平衡正向移动,生成Fe(OH)3沉淀,故答案为:溶液中存在铁离子的水解平衡:![]() ,向该体系中加入Na2CO3溶液后,CO32-和H+反应,使c(H+)降低,促进水解平衡正向移动,生成Fe(OH)3沉淀;
,向该体系中加入Na2CO3溶液后,CO32-和H+反应,使c(H+)降低,促进水解平衡正向移动,生成Fe(OH)3沉淀;
②NaClO具有强氧化性,可以将Mn2+氧化为MnO2,从而过滤除去,发生反应的离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
③由表格中的溶度积数据可知,草酸钴的溶度积比草酸钙大,与草酸镁很接近,则为了避免在沉钴时,将钙离子、镁离子同时沉淀,应先加入NH4F溶液,沉淀大部分的钙、镁的离子,再加入草酸沉淀钴离子,故答案为:草酸钴的溶度积比草酸钙大,与草酸镁很接近,先减少钙、镁离子的浓度,可以避免在沉钴时引入钙、镁杂质;
(5)5.49g CoC2O42H2O的物质的量为![]() ,则剩余的钴的氧化物固体中氧元素的物质的量为
,则剩余的钴的氧化物固体中氧元素的物质的量为![]() ,则该氧化物中Co与O元素物质的量之比为3:4,则该钴的氧化物的化学式为Co3O4,由此可知部分Co的化合价升高,失电子,则C元素应得电子,化合价降低,生成CO,根据得失电子守恒、元素守恒配平该方程式,还应有CO2和H2O生成,故发生反应的化学方程式为
,则该氧化物中Co与O元素物质的量之比为3:4,则该钴的氧化物的化学式为Co3O4,由此可知部分Co的化合价升高,失电子,则C元素应得电子,化合价降低,生成CO,根据得失电子守恒、元素守恒配平该方程式,还应有CO2和H2O生成,故发生反应的化学方程式为![]() ,故答案为:
,故答案为:。

 阅读快车系列答案
阅读快车系列答案