题目内容
W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质是大气污染物监测物之一;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态的电子排布式可表示为 。
(2)MX3-的空间构型 (用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是 。
(4)根据等电子原理,WX分子的结构式为 。
(5)1 mol WX2中含有的σ键数目为 。
(6)H2X分子中X原子轨道的杂化类型为 。
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式 。
(1)1s22s22p63s23p63d3(或[Ar]3d3)(2分)
(2)平面三角形(2分)
(3)N2H4分子中N为-2价,而NH3分子中N为-3价,负电性更高,导致N原子的孤对电子更易提供出来与H+结合,故碱性更强。(3分)
(4)C≡O (2分)
(5)2×6.02×1023个(或2NA)(2分)
(6)sp3(2分) 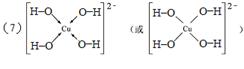 (2分)
(2分)
解析试题分析:(1)W的一种核素在考古时常用来鉴定一些文物的年代,W是C元素,M的氧化物是导致酸雨的主要物质之一,M是N元素,X的某一种单质是大气污染物监测物之一,则X是O元素;Y的基态原子核外有6个原子轨道处于半充满状态,则Y的价电子排布为3d54s1,所以Y是Cr,Z能形成红色的Z2O和黑色的ZO两种氧化物,Z是Cu。所以Y3+基态的电子排布式可表示为1s22s22p63s23p63d3
(2)NO3-离子中,N的价层电子对数为3+1/2(5+1-3×2)=3,所以MX3-的空间构型为平面正三角形;
(3)从化合价角度分析:N2H4分子中N为-2价,而NH3分子中N为-3价,负电性更高,导致N原子的孤对电子更易提供出来与H+结合,故碱性更强。
(4)CO与氮气是等电子体,化学结构相似,所以CO的结构式类似于氮气,存在三键结构;
(5)CO2分子中存在2个碳氧双键,每个双键都有1个σ键,所以1molCO2分子中存在2NAσ键;
(6)H2O分子中,O的价层电子对数是2+1/2(6-2)=4,所以是sp3杂化;
(7)向Cu2+加入过量NaOH溶液,可生成四羟基合铜络离子,结构式为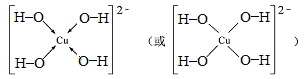
考点:考查元素推断,核外电子排布,空间构型的判断,等电子体的性质,化学键的判断,杂化类型的判断,配位离子的结构式的书写

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案(14分)A、B、C、D为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如下表所述。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 工业上常用电解熔融AD2制取A的单质。 | B的最外层电子数比最内层电子数多1。 | C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂。 | D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强。 |
(1)工业上制取A的单质的化学方程式: 。
(2)在25oC、10l kPa下,已知13.5g的B的固体单质在D的气体单质中完全燃烧后恢复至原状态,放热419 kJ,该反应的热化学方程式是 。
(3)Sn与元素C同主族,周期数比元素C的大2.则Sn的原子序数为 ;配制SnCl2溶液时需用盐酸溶解其晶体,其目的是 。
(4)甲中各原子都满足8电子稳定结构,其电子式为 ;甲溶于水后光照一段时间溶液酸性增强的原因(用离子方程式表示) 。
(5)将A的单质、B的单质棒用导线连接后插入稀NaOH溶液中。写出负极反应的电极方程式 。
元素的性质在元素周期表中按其排列呈现一定的规律。下表为元素周期表中部分元素,根据要求回答下列问题:
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上12种元素分别属于s区、d区、ds区和p区,则属于s区的元素有 种,属于d区的元素有 种。
(3)铜晶胞是面心立方结构。其空间利用率为 (用含“π”和“
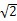 ”的式子表示,不必算结果)
”的式子表示,不必算结果) A~E五种元素中,除E外均为短周期元素,且原子序数依次增大。它们的原子
结构或性质如下表所示:
| 元素 | A | B | C | D | E |
| 结构或性质 | 原子半径最小的元素 | 地壳中含量最多的元素 | 可与B形成阴阳离子个数比为1:2的两种化合物 | 与B同主族 | 单质是生活中最常见的金属,可被磁铁吸引 |
(1)元素D在周期表中的位置为 。
(2)C与B形成原子个数比为1∶1的化合物中,含有的化学键类型为 。
(3)化合物甲、乙是由A、B、C、D四种元素中的三种组成的强电解质,且两种物质水溶液均显碱性。若甲能抑制水的电离,乙能促进水的电离,则化合物甲的电子式为 ;乙的化学式是 。
(4)以E构成的单质为Y极,碳棒为X极,在6 mol/L的NaOH溶液中进行电解,制取高效净水剂Na2YO4(溶液呈紫红色)。其装置如图。电解过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色,且Y电极变细;电解液澄清。Y极发生的电极反应为:4OH--4e-
 2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。
2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。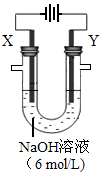
(5)Se是人体必备的微量元素,与B、D同一主族。Se的原子序数为34,且B、D、Se元素气态单质分别与H2反应生成1 mol气态氢化物的反应热如下:
a.+ 29.7 kJ/mol b.-20.6 kJ/mol c.-241.8 kJ/mol
表示生成1 mol H2Se的反应热是 (填序号);依据是: 。
 杂化
杂化 键和1个大
键和1个大 键,C2H2是非极性分子
键,C2H2是非极性分子 中不存在______________________________________。
中不存在______________________________________。