题目内容
【题目】根据所学知识,完成下面题目:
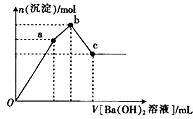
(1)同温、同压下等质量的SO3和NO2 , 它们所占的体积比为 , 所含氧元素的物质的量之比为 .
(2)2molO2与1molO3的摩尔质量的比是 .
(3)某化合物的相对分子质量为m,在t℃时A ml该化合物的饱和溶液为B g,将其蒸干后得到固体C g.该化合物在t℃时的溶解度为g,该饱和溶液中溶质的物质的量浓度为mol/L.
(4)实验室制取氯气的化学方程式为:4HCl(浓)+MnO2 ![]() Cl2↑+MnCl2+2H2O, 请回答:MnO2与被氧化的HCl的物质的量之比是;用单线桥法标出电子转移的方向和数目: .
Cl2↑+MnCl2+2H2O, 请回答:MnO2与被氧化的HCl的物质的量之比是;用单线桥法标出电子转移的方向和数目: .
【答案】
(1)23:40;69:80
(2)2:3
(3)![]() ;
;![]()
(4)1:2;![]()
【解析】解:(1)根据n= ![]() 可知,等质量的SO3和NO2的物质的量之比为46g/mol:80g/mol=23:40,同温同压下二者体积之比为23:40;而SO3中含3个氧原子,NO2含2个氧原子,故两者中含有氧原子物质的量之比为23×3:40×2=69:80,所以答案是:23:40;69:80;(2)摩尔质量以g/mol为单位,数值上等于其相对分子质量,2mol O2与1mol O3的摩尔质量的比是32g/mol:48g/mol=2:3,所以答案是:2:3;(3)饱和溶液中水的质量为(B﹣C)g,溶质质量为Cg,设溶解度为s,则100g:s=(B﹣C)g:Cg,解得s=
可知,等质量的SO3和NO2的物质的量之比为46g/mol:80g/mol=23:40,同温同压下二者体积之比为23:40;而SO3中含3个氧原子,NO2含2个氧原子,故两者中含有氧原子物质的量之比为23×3:40×2=69:80,所以答案是:23:40;69:80;(2)摩尔质量以g/mol为单位,数值上等于其相对分子质量,2mol O2与1mol O3的摩尔质量的比是32g/mol:48g/mol=2:3,所以答案是:2:3;(3)饱和溶液中水的质量为(B﹣C)g,溶质质量为Cg,设溶解度为s,则100g:s=(B﹣C)g:Cg,解得s= ![]() g;溶质的物质的量为
g;溶质的物质的量为 ![]() =
= ![]() mol,溶液物质的量浓度为
mol,溶液物质的量浓度为 ![]() =
= ![]() mol/L,所以答案是:
mol/L,所以答案是: ![]() ;
; ![]() mol/L(4)在此反应中,4molHCl的作用有两个:2mol被氧化为1mol氯气,失去2mol电子,2mol做酸,形成了盐,没有被氧化,故MnO2与被氧化的HCl的物质的量之比是1:2;2mol被氧化为1mol氯气,失去2mol电子,1mol二氧化锰被还原,得2mol电子,故用单线桥表示电子转移的情况为:
mol/L(4)在此反应中,4molHCl的作用有两个:2mol被氧化为1mol氯气,失去2mol电子,2mol做酸,形成了盐,没有被氧化,故MnO2与被氧化的HCl的物质的量之比是1:2;2mol被氧化为1mol氯气,失去2mol电子,1mol二氧化锰被还原,得2mol电子,故用单线桥表示电子转移的情况为: ![]() .所以答案是:1:2,
.所以答案是:1:2, ![]() .
.
【考点精析】解答此题的关键在于理解溶解度、饱和溶液的概念的相关知识,掌握在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫作这种溶质的饱和溶液;还能继续溶解某种溶质的溶液,叫作不饱和溶液;在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫作这种物质在这种物质在这种溶剂里的溶解度.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案