题目内容
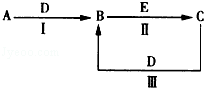
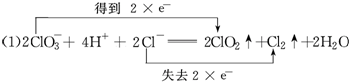
13.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯.反应的化学方程式为:2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O.(1)将上述反应改写成离子方程式并分析电子转移的情况(双线桥法表示)
 ;
;(2)浓盐酸在反应中显示出来的性质是①④(填写编号).
①还原性;②氧化性和还原性;③氧化性;④酸性
(3)已知浓盐酸的密度为1.18g/cm3,质量分数为36.5%,则该盐酸的物质的量浓度是11.8 mol/L.
(4)ClO2具有很强的氧化性.因此,常被用作消毒剂(还原产物是Cl-),其消毒的效率(以单位质量得到的电子数表示)是Cl2的2.63倍.
分析 (1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,该反应转移2e-;
(2)反应中盐酸表现为酸性和还原性;
(3)结合c=$\frac{1000ρw%}{M}$计算;
(4)1molCl2可以获得2mol电子,1molClO2可以获得电子5mol电子,以此进行计算.
解答 解:(1)由2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O可知,KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,该反应转移2e-,该反应电子转移的情况为 ,
,
故答案为: ;
;
(2)在反应2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O中,HCl中Cl元素的化合价由-1价升高0,则HCl具有还原性,又该反应生成盐KCl,则表现酸的酸性,
故答案为:①④;
(3)浓盐酸的密度为1.18g/cm3,质量分数为36.5%,则该盐酸的物质的量浓度是c=$\frac{1000×1.18×36.5%}{36.5}$=11.8 mol/L,故答案为:11.8 mol/L;
(4)设质量都是71g,氯气得到的电子数为$\frac{71g}{71g/mol}$×2×1=2mol,
ClO2得到的电子数为$\frac{71g}{67.5g/mol}$×1×5=$\frac{71}{13.5}$mol,
则ClO2消毒的效率是Cl2的倍数为$\frac{\frac{71}{13.5}mol}{2mol}$=2.63,
故答案为:2.63.
点评 本题以氯气的制法来考查氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握氧化还原反应中转移的电子数的计算,明确化合价的变化是分析的关键,难点是消毒效率的计算,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 150mL 1mol/L NaCl溶液 | B. | 75mL 2mol/L NH4Cl溶液 | ||
| C. | 150mL 1.5mol/L MgCl2溶液 | D. | 75mL 2mol/L AlCl3溶液 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | Li | Be | B | C | N | O | F | Ne |
| 三 | Na | Mg | Al | Si | P | S | Cl | Ar |
(2)P、N、Mg原子半径由小到大的顺序是:N<P<Mg
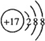
(3)Cl-的离子结构示意图是:
(4)最高价氧化物对应水化物酸性最强的是:高氯酸 (填名称).:
(5)形成化合物种类最多的元素是:C
(6)Si的最高价氧化物对应的水化物的化学式为:H2SiO3
(7)Na与CuSO4溶液反应的化学方程式为(分步写):2Na+2H2O═2NaOH+H2↑;2NaOH+CuSO4=Cu(OH)2+Na2SO4.
| A. | 能全部透过半透膜 | B. | 能全部通过滤纸 | ||
| C. | 粒子做布朗运动 | D. | 有电泳现象 |
| A. | Al(OH)3可以用来做胃酸中和剂 | |
| B. | 铝与任何酸、碱都能反应放出氢气 | |
| C. | 不宜用铝制品来蒸煮酸性或碱性食物 | |
| D. | Al2O3可以用来制造耐火坩埚、耐火管等实验仪器 |
| A. | 两种气体的物质的量之比为3:2 | B. | 两种容器的体积之比为2:3 | ||
| C. | 两种气体的分子数相等 | D. | 两种气体的密度之比是3:2 |