题目内容
12.同分异构现象是有机物种类繁多的重要原因之一,下列互为同分异构体的一组化合物是( )| A. | 甲烷和乙烷 | B. | 乙醇和乙酸 | C. | 正丁烷和异丁烷 | D. | 氯乙烯和乙烯 |
分析 具有相同分子式而结构不同的化合物互为同分异构体;
有机化合物中具有同一通式、组成上相差一个或多个CH2原子团、在结构与性质上相似的化合物互为同系物,据此进行解答.
解答 解:A.甲烷和乙烷分子式不同,都是烷烃,互为同系物,故A错误;
B.乙醇和乙酸的分子式不同,不属于同分异构体,故B错误;
C.正丁烷和异丁烷分子式相同、结构不同,二者互为同分异构体,故C正确;
D.氯乙烯和乙烯的分子式不同,不属于同分异构体,故D错误.
故选C.
点评 本题考查了同分异构体、同系物的判断,题目难度不大,注意掌握同系物、同分异构体的概念及区别,试题培养了学生灵活应用基础知识解决实际问题的能力.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
2.“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
(1)NaCN溶液呈碱性的原因是CN-+H2O?HCN+OH- (用离子方程式表示)
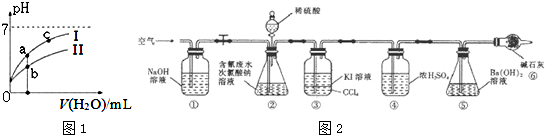
(2)如图1表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是CD
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度
的大小关系是:c(Na+)>c(CN-)>c(HCOO-)>c(OH-)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:
CN-+CO2+H2O=HCN+CO32-
C.图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR).c(O{H}^{-})}$相等(HR代表HCOOH或HCN)
D.图象中a点酸的总浓度小于b点酸的总浓度
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为KHCO3.
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-)<c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用如图2所示装置进行实验.将CN-的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4,关闭活塞.
已知装置②中发生的主要反应依次为:
CN-+ClO-═CNO-+Cl-
2CNO-+2H++3C1O-═N2↑+2CO2↑+3C1-+H2O
(5)①和⑥的作用是吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰.
(6)反应结束后,缓缓通人空气的目的是使生成的气体全部进入装置⑤.
(7)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置⑤反应前后的质量(从装置①到⑥中选择,填装置序号).

探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(2)如图1表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是CD
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度
的大小关系是:c(Na+)>c(CN-)>c(HCOO-)>c(OH-)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:
CN-+CO2+H2O=HCN+CO32-
C.图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR).c(O{H}^{-})}$相等(HR代表HCOOH或HCN)
D.图象中a点酸的总浓度小于b点酸的总浓度
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为KHCO3.
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-)<c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用如图2所示装置进行实验.将CN-的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4,关闭活塞.
已知装置②中发生的主要反应依次为:
CN-+ClO-═CNO-+Cl-
2CNO-+2H++3C1O-═N2↑+2CO2↑+3C1-+H2O
(5)①和⑥的作用是吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰.
(6)反应结束后,缓缓通人空气的目的是使生成的气体全部进入装置⑤.
(7)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置⑤反应前后的质量(从装置①到⑥中选择,填装置序号).
3.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 30g乙烷含有的共价键数目为8NA | |
| B. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| C. | 1mol甲基含10 NA个电子 | |
| D. | 标况下,22.4L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA |
17.已知H2O2在催化剂作用下分解,能量随反应进程的变化如图,下列说法正确的是( )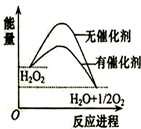

| A. | 该反应是吸热反应 | |
| B. | 加入催化剂,H2O2分解产生的O2量增多 | |
| C. | H2O2分解的热化学方程式:2H2O2?2H2O+O2↑△H<0 | |
| D. | 加入催化剂,降低了反应的活化能 |
4.化学与科学、技术、社会密切相关,下列做法或说法正确的是( )
| A. | 从海带中提取碘的过程中得到碘的四氯化碳溶液,可用蒸发的方法分离出碘 | |
| B. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料有利于减少白色污染 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 控制雾霾需要从控制氮氧化物、二氧化硫和二氧化碳等大气污染物排放着手 |
2.下列指定反应的离子方程式一定错误的是( )
| A. | NH4HCO3溶液与Ba(OH)2溶液:NH4++HCO3-+Ba2++2OH-=NH3•H2O+BaCO3↓+H2O | |
| B. | FeBr2溶液中通入氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | 苏打溶液与稀盐酸混合:HCO3-+H+=CO2↑+H2O | |
| D. | 向澄清石灰水中通入过量CO2:OH-+CO2=HCO3- |

