题目内容
【题目】氧化锌为白色固体,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
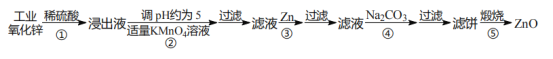
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是 MnO2。回答下列问题:
(1)为加快步骤①的浸取速率,下列措施中无法达到目的是_____(填字母)。
a.将样品粉碎 b.延长浸取时间 c.充分搅拌
d.适当增加硫酸浓度 e.适当升高温度
(2)反应②中除掉的杂质离子是_____(填离子符号),发生反应的离子方程式为:_____。
(3)加入高锰酸钾溶液前,若 pH 较低,对除杂的影响是_____。
(4)步骤③过滤得到的滤渣中,除了过量的锌外还有_____。
(5)反应④中产物的成分可能是 ZnCO3xZn(OH)2。取干燥后的滤饼 11.2 g,煅烧后可得到产品 8.1 g,则 x=_____(ZnCO3、Zn(OH)2 的相对分子质量分别为:125、99)。
【答案】b ![]() 、
、![]()
![]() 、
、![]() 若pH较低,
若pH较低,![]() 的氧化性增强,还原产物就不是
的氧化性增强,还原产物就不是![]() 沉淀而是
沉淀而是![]() ,同时也不利于
,同时也不利于![]() 沉淀的生成 镍 1
沉淀的生成 镍 1
【解析】
本题是一道无机化学工业流程题,首先明确我们的目标是纯化工业级氧化锌,因此第一步先加稀硫酸溶解,浸出液中加适量![]() 可以将
可以将![]() 氧化成
氧化成![]() 并通过调节pH转化为
并通过调节pH转化为![]() 沉淀,同时+7价锰和+2价锰发生归中反应产生
沉淀,同时+7价锰和+2价锰发生归中反应产生![]() 沉淀,接着过滤除去
沉淀,接着过滤除去![]() 和
和![]() 。 加入锌粒还原溶液中剩余的镍离子,再过滤除去单质镍和过量的锌粒,加入碳酸钠得到碳酸锌沉淀,过滤后煅烧碳酸锌分解产生氧化锌,本题得解。
。 加入锌粒还原溶液中剩余的镍离子,再过滤除去单质镍和过量的锌粒,加入碳酸钠得到碳酸锌沉淀,过滤后煅烧碳酸锌分解产生氧化锌,本题得解。
(1)a.将样品粉碎可以增大接触面积,加快反应进行,a项正确;
b.延长浸取时间无法加快浸取速率,只能增大浸出率,b项错误;
c.充分搅拌本质上可以起到增大接触面积的作用,因此也可以加快反应速率,c项正确;
d.适当增加硫酸浓度相当于增大了反应物浓度,正反应速率加快,d项正确;
e.适当升高温度也可以增大反应速率,e项正确;
答案选b;
(2)根据分析反应②中除掉的是![]() 和
和![]() ,因此写出对应的反应方程式即可,分别为:
,因此写出对应的反应方程式即可,分别为:![]() 和
和![]() ;
;
(3)若溶液pH较低,首先![]() 的氧化性增强,还原产物就不是
的氧化性增强,还原产物就不是![]() 沉淀而是
沉淀而是![]() ,引入了新的杂质,其次也不利于
,引入了新的杂质,其次也不利于![]() 沉淀的生成;
沉淀的生成;
(4)根据分析还有单质镍;
(5)一个自然的想法就是列二元一次方程来求解,设滤饼中有![]() 共x mol,
共x mol,![]() 共y mol,首先根据质量关系有:
共y mol,首先根据质量关系有:![]() ,又因为二者的分解产物均为
,又因为二者的分解产物均为![]() ,煅烧后的8.1g其实就是
,煅烧后的8.1g其实就是![]() 的
的![]() ,也就是说锌一共有0.1mol,因此根据物质的量关系有
,也就是说锌一共有0.1mol,因此根据物质的量关系有![]() ,联立两个方程解出
,联立两个方程解出![]() 、
、![]() ,也就是说
,也就是说![]() 和
和![]() 的物质的量为1:1,化学式中的x自然为1。
的物质的量为1:1,化学式中的x自然为1。

【题目】1905年哈珀开发实现了以氮气和氢气为原料合成氨气,生产的氨制造氮肥服务于农业,养活了地球三分之一的人口,哈珀也因此获得了1918年的诺贝尔化学奖。
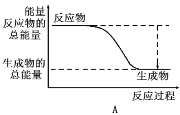
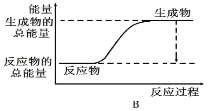
(1)工业合成氨的反应如下:N2+3H2 2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成2 mol NH3 的能量变化为__________kJ。 下图能正确表示该反应中能量变化的是__________(填“A”或“B”)。
2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成2 mol NH3 的能量变化为__________kJ。 下图能正确表示该反应中能量变化的是__________(填“A”或“B”)。
(2)反应2NH3(g)![]() N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为 0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为 0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
① | 400℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
② | 400℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
③ | 500℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据回答:实验①②中,有一个实验使用了催化剂,它是实验_____(填序号);实验①③对比说明了_________________________________。在恒温恒容条件下,判断该反应达到化学平衡状态的标志是_________(填序号)。
a. NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
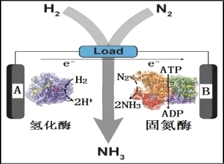
(3)近日美国犹他大学 Minteer教授成功构筑了H2—N2生物燃料电池。该电池类似燃料电池原理,以氮气和氢气为原料、氢化酶和固氮酶为两极催化剂、质子交换膜(能够传递H+)为隔膜,在室温条件下即实现了氨的合成同时还能提供电能。则A电极为_____极(填“正”、“负”),该电池放电时溶液中的H+向______极移动(填“A”、“B”)。
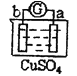
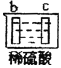
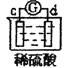
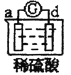
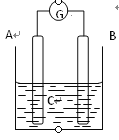
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c