题目内容
【题目】氢能是理想的清洁能源,资源丰富。以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下:

(1)过程I :2Fe3O4(s)![]() 6FeO(s)+O2(g) △H=+313.2 kJ/mol
6FeO(s)+O2(g) △H=+313.2 kJ/mol
①过程I需要将O2不断分离出去,目的是______________。
②一定温度下,在容积可变的密闭容器中,该反应已达到平衡。下列说法正确的是____(填字母标号) 。
a.容器内气体密度和相对分子质量都不再改变
b.升高温度,容器内气体密度变大
c.向容器中通入N2,Fe3O4 转化率不变
d.缩小容器容积,O2(g)浓度变大
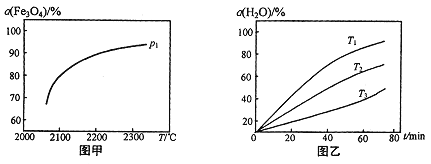
③在压强p1下,Fe3O4的平衡转化率随温度变化的曲线如图甲所示。若将压强由p1增大到p2在图甲中画出p2的α(Fe3O4)~T 曲线示意图。___________
(2)已知H2的燃烧热是285.8kJ/mol,则液态水通过过程II转化的热化学方程式为______。
(3)其他条件不变时,过程II在不同温度下,H2O的转化率随时间的变化α(H2O)~t曲线如图乙所示,温度T1、T2、T3由大到小的关系是_________,判断依据是_________。
(4)科研人员研制出透氧膜(OTM),它允许电子和O2-同时透过,可实现水连续分解制H2,工作时CO、H2O分别在透氧膜的两侧反应。工作原理如图所示:
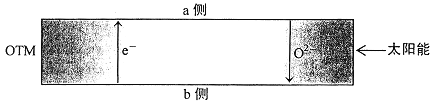
CO 在________侧反应(填“a”或“b”),另一侧的电极反应式为______________。
【答案】提高Fe3O4的转化率 ab  3FeO(s)+ H2O(l)=H2(g)+ Fe3O4(s) △H =+129.2kJ/mol Tl>T2>T3 其他条件相同时,图像斜率Tl>T2>T3,即反应速率Tl>T2>T3,而温度越高,反应速率越快,所以Tl>T2>T3 b H2O+2e-=H2+O2-
3FeO(s)+ H2O(l)=H2(g)+ Fe3O4(s) △H =+129.2kJ/mol Tl>T2>T3 其他条件相同时,图像斜率Tl>T2>T3,即反应速率Tl>T2>T3,而温度越高,反应速率越快,所以Tl>T2>T3 b H2O+2e-=H2+O2-
【解析】
(1)过程Ⅰ:2Fe3O4(s)6FeO(s)+O2(g)△H=+313.18kJmol-1。
①将O2分离出去,平衡正向移动,目的是提高Fe3O4的转化率,故答案为:提高Fe3O4的转化率;
②a.容器内只有氧气,温度不变,平衡常数不变,氧气的浓度不变,则平衡时气体密度和相对分子质量不变,正确;b.正反应为吸热反应,升高温度,平衡正向移动,平衡常数增大,氧气的浓度增大,相当于体积减小,容器内气体密度变大,正确;c.向容器中通入N2,容器的体积增大,氧气的浓度减小,平衡正向移动,Fe3O4转化率增大,错误;d.温度不变,平衡常数不变,缩小容器容积,O2(g)浓度不变,错误;故选ab;
③压强增大,平衡向气体系数减小的方向移动,平衡逆向移动,Fe3O4的转化率降低,所以图像为: ,故答案为:
,故答案为: ;
;
(2)由图可知:过程Ⅱ的化学方程式是氧化亚铁与水反应生成四氧化三铁和氢气,所以反应方程式为:3FeO+H2OFe3O4+H2,过程Ⅰ:①2Fe3O4(s)6FeO(s)+O2(g)△H=+313.18kJmol-1,H2的燃烧热是285.8kJ/mol,即②H2(g)+![]() O2(g)=H2O(l) △H=—285.8kJ/mol,根据盖斯定律,将(①×
O2(g)=H2O(l) △H=—285.8kJ/mol,根据盖斯定律,将(①×![]() +②)×-1得:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+129.2kJ/mol,故答案为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+129.2kJ/mol;
+②)×-1得:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+129.2kJ/mol,故答案为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+129.2kJ/mol;
(3)T1>T2>T3;初始压强相同,浓度相同,图像斜率T1>T2>T3,温度越高,反应速率越大,则说明T1>T2>T3,故答案为:T1>T2>T3;其他条件相同时,图像斜率Tl>T2>T3,即反应速率Tl>T2>T3,而温度越高,反应速率越快,所以Tl>T2>T3;
(4)本实验利用水制取氢气,H2O得电子生成H2和O2-,O2-通过OTM进入b侧,所以H2O在a侧,CO在b侧反应,a侧的电极反应式为H2O+2e-=H2+O2-,故答案为:b;H2O+2e-=H2+O2-。

【题目】前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为______;基态D原子核外电子占据的能量最高的能级符号为_____________。
(2)A元素的各级电离能如下:
能级(I) | I1 | I2 | I3 | I4 | I5 |
电离能/kJ·mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
分析上表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是__________。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是________。
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是_______(填分子式)。
(5)(DC)4为热色性固体,且有色温效应。低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是____;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______。在B、C、D的简单气态氢化物中,属于非极性分子的是______(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是_______________。
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示。已知:该晶体密度为ρg·㎝-3,NA代表阿伏伽德罗常数的值。

①该晶体的化学式为__________。
②在该晶体中,A与C形成共价键的键长(d)为_____pm。