题目内容
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO═3H++6H2O+(CH2)6N4H+[酸碱中和滴定时,1mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g.
步骤 II 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤 III 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
请根据步骤 III回答下列问题:
(1)该实验用的是50ml滴定管,如果液面处的读数是aml,则滴定管中液体的体积 (填代号)
A.是a ml B.是(50-a)ml C.一定大于a ml D.一定大于(50-a)ml
(2)锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)
(3)滴定时边滴边摇动锥形瓶,眼睛应观察 ,滴定终点的判断依据为: .
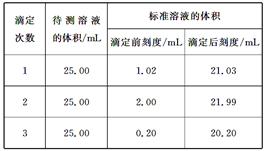
(4)滴定结果如表所示:
若NaOH标准溶液的浓度为0.1010mol?L-1,则该样品中氮的质量分数为 .
步骤I 称取样品1.500g.
步骤 II 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤 III 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
请根据步骤 III回答下列问题:
(1)该实验用的是50ml滴定管,如果液面处的读数是aml,则滴定管中液体的体积
A.是a ml B.是(50-a)ml C.一定大于a ml D.一定大于(50-a)ml
(2)锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积
(3)滴定时边滴边摇动锥形瓶,眼睛应观察
(4)滴定结果如表所示:
| 滴定 次数] |
待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
分析:(1)液面处的读数是aml,则有读数部分的液体体积为(50-a)mL,滴定管下端有一定没有刻度,滴定管内液体的体积大于(50-a)mL;
(2)锥形瓶用蒸馏水洗涤后,虽然水未倒尽,但待测液中的H+的物质的量不变,则滴定时所需NaOH标准溶液中的氢氧化钠的物质的量就不变,不影响氢氧化钠溶液的体积;
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察颜色变化,确定滴定终点;
待测液为酸性,酚酞应为无色,当溶液转为碱性时,溶液颜色变为浅红色且半分钟内不褪色,说明到达终点;
(4)标准溶液的体积应取三次实验的平均值,根据题意,中性甲醛溶液一定是过量的,而且1.500g 铵盐 经溶解后,取了其中1/10进行滴定,即0.15g,根据n=cV计算消耗氢氧化钠的物质的量,进而计算H+[含(CH2)6N4H+]的物质的量,根据方程式可知每生成4molH+[含(CH2)6N4H+]会消耗NH4+4mol,据此计算铵根离子物质的量,再计算氮元素的质量,据此计算解答.
(2)锥形瓶用蒸馏水洗涤后,虽然水未倒尽,但待测液中的H+的物质的量不变,则滴定时所需NaOH标准溶液中的氢氧化钠的物质的量就不变,不影响氢氧化钠溶液的体积;
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察颜色变化,确定滴定终点;
待测液为酸性,酚酞应为无色,当溶液转为碱性时,溶液颜色变为浅红色且半分钟内不褪色,说明到达终点;
(4)标准溶液的体积应取三次实验的平均值,根据题意,中性甲醛溶液一定是过量的,而且1.500g 铵盐 经溶解后,取了其中1/10进行滴定,即0.15g,根据n=cV计算消耗氢氧化钠的物质的量,进而计算H+[含(CH2)6N4H+]的物质的量,根据方程式可知每生成4molH+[含(CH2)6N4H+]会消耗NH4+4mol,据此计算铵根离子物质的量,再计算氮元素的质量,据此计算解答.
解答:解:(1)液面处的读数是aml,则有读数部分的液体体积为(50-a)mL,滴定管下端有一定没有刻度,滴定管内液体的体积大于(50-a)mL,
故答案为:D;
(2)锥形瓶用蒸馏水洗涤后,虽然水未倒尽,但待测液中的H+的物质的量不变,则滴定时所需NaOH标准溶液中的氢氧化钠的物质的量就不变,不影响氢氧化钠溶液的体积,
故答案为:无影响;
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察锥形瓶内溶液颜色变化,确定滴定终点;
待测液为酸性,酚酞应为无色,当溶液转为碱性时,溶液颜色变为浅红色,且半分钟内不褪色,说明到达终点,
故答案为:锥形瓶内溶液颜色的变化;溶液刚好由无色变为浅红色,且半分钟内不褪色
(4)标准溶液的体积应取三次实验的平均值为
=20.00mL,
根据题意,中性甲醛溶液一定是过量的,而且1.500g 铵盐 经溶解后,取了其中1/10进行滴定,即0.15g,
滴定结果,溶液中含有H+[含(CH2)6N4H+]共0.02L×0.1010mol/L=0.00202mol
根据方程式可知每生成4molH+[含(CH2)6N4H+]会消耗NH4+4mol,所以共消耗NH4+0.00202mol,
其中含氮元素0.00202mol×14g/mol=0.02828g
所以氮的质量分数为
×100%=18.85%,
故答案为:18.85%.
故答案为:D;
(2)锥形瓶用蒸馏水洗涤后,虽然水未倒尽,但待测液中的H+的物质的量不变,则滴定时所需NaOH标准溶液中的氢氧化钠的物质的量就不变,不影响氢氧化钠溶液的体积,
故答案为:无影响;
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察锥形瓶内溶液颜色变化,确定滴定终点;
待测液为酸性,酚酞应为无色,当溶液转为碱性时,溶液颜色变为浅红色,且半分钟内不褪色,说明到达终点,
故答案为:锥形瓶内溶液颜色的变化;溶液刚好由无色变为浅红色,且半分钟内不褪色
(4)标准溶液的体积应取三次实验的平均值为
| (21.03-1.02)mL+(21.99-2.00)mL+(20.20-0.20)mL |
| 3 |
根据题意,中性甲醛溶液一定是过量的,而且1.500g 铵盐 经溶解后,取了其中1/10进行滴定,即0.15g,
滴定结果,溶液中含有H+[含(CH2)6N4H+]共0.02L×0.1010mol/L=0.00202mol
根据方程式可知每生成4molH+[含(CH2)6N4H+]会消耗NH4+4mol,所以共消耗NH4+0.00202mol,
其中含氮元素0.00202mol×14g/mol=0.02828g
所以氮的质量分数为
| 0.02828g |
| 0.15g |
故答案为:18.85%.
点评:本题考查了中和滴定实验的原理以及操作步骤、对数据的处理、仪器结构等,难度中等,掌握滴定原理是关键,注意根据氢氧化钠计算铵根离子的物质的量,计算氮元素质量分数为易错点.

练习册系列答案
相关题目