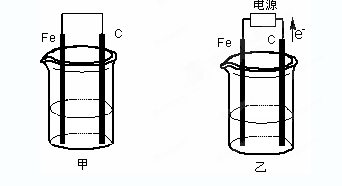
题目内容
如图所示装置:
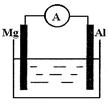
(1)若烧杯中溶液为稀硫酸,则观察到的现象为 。
两极反应式为:正极 ;
负极 ,该装置将 能转化为 能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 ,
总反应方程式为 。

(1)若烧杯中溶液为稀硫酸,则观察到的现象为 。
两极反应式为:正极 ;
负极 ,该装置将 能转化为 能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 ,
总反应方程式为 。
(1)铝的表面有气泡冒出,镁逐渐溶解;2H++2 e-= H2↑;Mg-2 e-=" Mg" 2+ 化学 电
(2)铝 2Al+2NaOH+2H2O==NaAlO2+3 H2↑ (2分)(其余每空1分)
(2)铝 2Al+2NaOH+2H2O==NaAlO2+3 H2↑ (2分)(其余每空1分)
试题分析:(1)烧杯中溶液为稀硫酸,则该电池为镁铝原电池,镁有负极,铝为正极,镁极溶解,而铝极析出氢气,所以观察到的现象为铝的表面有气泡冒出,镁逐渐溶解;该原电池中负极发生的反应为:Mg-2 e-=" Mg" 2+ ;正极发生的反应为:2H++2 e-= H2↑;该装置是将化学能转化为电能;(2)若烧杯中溶液为氢氧化钠溶液,由于铝为两性物质,所以铝作为负极,而镁有正极,在镁上有氢气析出,而铝极溶解,其总的化学反应方程式为:2Al+2NaOH+2H2O==NaAlO2+3 H2↑。
点评:本题考查了原电池,该考点是高考考查的重点和难点,本题侧重对原电池基础知识的考查,本题难度中等。

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目

 2Fe3+
2Fe3+