题目内容
13. 如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH30H+302→2C02+4H20.下列说法正确的是( )
如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH30H+302→2C02+4H20.下列说法正确的是( )| A. | 左电极为电池的负极,a处通入的物质是甲醇 | |
| B. | 右电极为电池的负极,b处通入的物质是空气 | |
| C. | 负极反应式为:CH30H+H20-6e-→CO2+6H+ | |
| D. | 正极反应式为:02+2H20+4e-→40H- |
分析 A、依据图中电子流向分析,原电池中电子是从负极流向正极;电子流出的一端是负极,失电子发生氧化反应;
B、依据图中电子流向分析,原电池中电子是从负极流向正极;电子流出的一端是负极,流入的一端为正极,得到电子发生还原反应;
C、负极是甲醇失电子发生氧化反应,依据电极反应的产物和环境写出电极反应式;
D、正极是氧气得到电子发生还原反应,氧气得到电子生成氢氧根离子,在图中是酸性介质,电极反应产物应写成水的形式.
解答 解:A、依据图中电子流向分析,原电池中电子是从负极流向正极;电子流出的一端是负极,失电子发生氧化反应;所以左电极为电池的负极,a处是失电子的一端,通的是甲醇,故A正确;
B、原电池中电子是从负极流向正极;电子流出的一端是负极,流入的一端为正极,得到电子发生还原反应;电子流入的一端是正极,通入氧气得到电子发生还原反应,故B错误;
C、负极是甲醇失电子发生氧化反应,依据电池反应和酸性环境,2CH3OH+3O2=2CO2+4H2O,负极电极反应为:CH3OH+H2O-6e-=CO2+6H+,故C正确;
D、正极是氧气得到电子发生还原反应,氧气得到电子生成氢氧根离子,在图中是酸性介质,电极反应产物应写成水的形式;电池的正极反应式为:O2+4H++4e-=2H2O,故D错误;
故选AC.
点评 本题考查了原电池的原理应用,电极判断,电极名称,电极反应,电极反应式书写的分析判断,掌握原电池原理是解题关键,燃料电池的特征是燃料是电子在负极反应,氧气再正极发生还原反应,题目难度中等.

练习册系列答案
相关题目
4.下列各组选项按照电解质→非电解质→单质→混合物顺序排列的一项是( )
| A. | 盐酸→SO3→石墨→Na2CO3•10H2O | B. | NaCl→NH3→铜→空气 | ||
| C. | 蔗糖→CuSO4→N2→Fe(OH)3胶体 | D. | KCl→CaO→液氯→石灰水 |
1.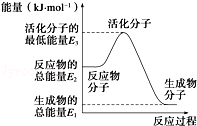 已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
②N2(g)+3H2(g)≒2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
 已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1②N2(g)+3H2(g)≒2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
| A. | 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1mol N2和3mol H2,反应后放出的热量为Q1 kJ,若通入2mol N2和6mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨催化氧化反应为4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
8.工业上制备溴单质时常用纯碱溶液吸收溴,发生的反应为:3Br2+6Na2CO3+3H2O═5NaBr+NaBrO3+6NaHCO3,下列有关说法正确的是( )
| A. | 上述反应若有0.9molBr2反应,转移电子为1.5×6.02×1023个 | |
| B. | 反应后溶液的PH增大 | |
| C. | 若将NaBr和NaBrO3转变为Br2,需要在碱性条件下进行 | |
| D. | 该反应Na2CO3既是氧化剂又是还原剂 |
5.下列叙述正确的是( )
①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量气体所占的体积,其单位是L
④在同温同体积时,气体的物质的量越大,则压强越大
⑤用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液.
①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量气体所占的体积,其单位是L
④在同温同体积时,气体的物质的量越大,则压强越大
⑤用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液.
| A. | ①②④ | B. | ①③⑤ | C. | ②③ | D. | ②④⑤ |
2.A、B、C、D、E为原子序数依次增大的短周期主族元素,A原子的最外层电子数为内层电子数的2倍,B原子的M电子层有1个电子,C的氢氧化物既能与强酸反应又能与强碱反应,D的最高正价和最低负价的代数和为4,E在同周期主族元素中原子半径最小.下列叙述错误的是( )
| A. | 元素C位于周期表中第三周期ⅢA族 | |
| B. | 熔融电解化合物CE3可制取单质C | |
| C. | D的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | 化合物B2D2中既含离子键又含非极性共价键 |
3.下列叙述中,正确的是( )
| A. | 强电解质的导电性一定比弱电解质的导电性强 | |
| B. | 溶解度小的物质的导电性一定比溶解度大的物质的导电性弱 | |
| C. | 金属元素从化合态变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子得电子多时氧化性强 |
 掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.