题目内容
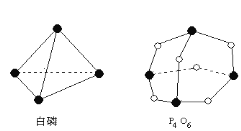
【题目】I.已知:P4(白磷)+3O2(g)= P4O6(g)的反应热△H=-1638 kJ·mol1 ,白磷和P4O6的分子结构如图所示,化学键的键能(kJ·mol1):P—P:198 P—O:360,则断开1molO2所需要的能量为 kJ
II.已知:①CO(g)+1/2O2(g)=CO2(g) △H=-141kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-883kJ·mol-1
(1)利用CO、H2化合制得1mol气态甲醇的热化学方程式为 ;
(2)若在恒温2L密闭容器中,将1molCO与3mol H2充分反应,当吸收能量为129KJ时,此时H2的转化率为 ,平衡常数为 。
【答案】Ⅰ498
Ⅱ(1)CO(g)+2H2(g)=CH3OH(g)△H=+258kJ·mol-1
(2)1/3(或33.3%);1L2·mol-2
【解析】
试题分析:设断开1molO2所需要的能量为xkJ,根据焓变=反应物的总键能-生成物的总键能,-1638 kJ=6×198+3x-12×360,x=498kJ;Ⅱ(1)根据盖斯定律,①+②-③得CO、H2化合制得1mol气态甲醇的热化学方程式为CO(g) +2H2(g)=CH3OH(g) △H=+258kJ·mol-1;(2)若在恒温2L密闭容器中,将1molCO与3mol H2充分反应,当吸收能量为129KJ时,设参加反应的CO、H2的物质的量分别是xmol、ymol
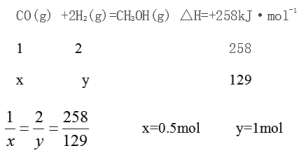
此时H2的转化率为![]() 33.3%,
33.3%,

平衡常数为![]() =1L2·mol-2。
=1L2·mol-2。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目