题目内容
(2010?西城区模拟)某小组同学将一定浓度Na2CO3溶液滴入CuSO4溶液中发现生成了蓝色沉淀.甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数.
已知:CuCO3和Cu(OH)2均为蓝色,难溶于水.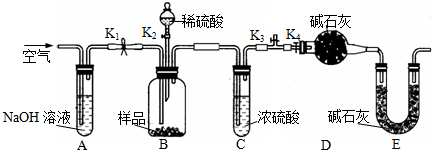
(1)按照甲同学的观点,发生的反应属于4种基本反应类型中的
(2)乙同学利用如图所示装置进行测定.
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化.具体操作依次为
②装置E中碱石灰的作用是
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应;
b.打开K1、K4,关闭K2、K3,通入过量空气;
c.打开K1、K3,关闭K2、K4,通入过量空气正确的顺序是(填选项序号,下同)
④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为
×100%
×100%.
(3)丙同学认为还可以通过测量CO2的体积或测量
已知:CuCO3和Cu(OH)2均为蓝色,难溶于水.

(1)按照甲同学的观点,发生的反应属于4种基本反应类型中的
复分解反应
复分解反应
.(2)乙同学利用如图所示装置进行测定.
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化.具体操作依次为
过滤
过滤
、洗涤、干燥;②装置E中碱石灰的作用是
防止空气中CO2和水蒸气进入装置D影响二氧化碳的质量测定
防止空气中CO2和水蒸气进入装置D影响二氧化碳的质量测定
;③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应;
b.打开K1、K4,关闭K2、K3,通入过量空气;
c.打开K1、K3,关闭K2、K4,通入过量空气正确的顺序是(填选项序号,下同)
cab
cab
.若未进行步骤b
b
,将使测量结果偏低;④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为
| 31n |
| 11m |
| 31n |
| 11m |
(3)丙同学认为还可以通过测量CO2的体积或测量
样品质量和样品充分灼烧后的质量
样品质量和样品充分灼烧后的质量
来测定沉淀中CuCO3的质量分数.分析:(1)甲同学认为沉淀是CuCO3,则发生反应为Na2CO3+CuSO4═CuCO3↓+Na2SO4;
(2)①在研究沉淀物组成前,须将沉淀从溶液中分离并净化,需要过滤、洗涤、干燥;
②实验通过测定D装置质量装置确定二氧化碳的质量,进而确定沉淀中碳酸铜的质量,计算碳酸铜的质量分数.装置E中碱石灰的作用是吸收空气中的CO2和水蒸气,防止空气中CO2和水蒸气进入装置D影响二氧化碳的质量测定;
③实验通过测定D装置质量装置确定二氧化碳的质量,进而确定沉淀中碳酸铜的质量,计算碳酸铜的质量分数.开始装置内含有二氧化碳,应向装置内通入除去二氧化碳的空气,排尽装置内的二氧化碳,故应打开K1、K3,关闭K2、K4;然后从分液漏斗中加入硫酸,充分反应;故应关闭K1、K3,打开K2、K4;反应完毕,容器内残留部分二氧化碳,应向装置内通入除去二氧化碳的空气,排出装置内的二氧化碳使反应生成的二氧化碳被装置D完全吸收,否则会导致二氧化碳测定的质量偏低,测定碳酸铜的质量分数偏低;
④装置D的质量增加的ng为反应生成的二氧化碳的质量,计算二氧化碳的物质的量,根据碳元素守恒可知n(CuCO3)=n(CO2),进而计算沉淀中CuCO3的质量分数;
(3)除题中实验方案外,还可以通过测量CO2的体积或测量样品质量和样品充分灼烧后的质量等方法来测定沉淀中CuCO3的质量分数.
(2)①在研究沉淀物组成前,须将沉淀从溶液中分离并净化,需要过滤、洗涤、干燥;
②实验通过测定D装置质量装置确定二氧化碳的质量,进而确定沉淀中碳酸铜的质量,计算碳酸铜的质量分数.装置E中碱石灰的作用是吸收空气中的CO2和水蒸气,防止空气中CO2和水蒸气进入装置D影响二氧化碳的质量测定;
③实验通过测定D装置质量装置确定二氧化碳的质量,进而确定沉淀中碳酸铜的质量,计算碳酸铜的质量分数.开始装置内含有二氧化碳,应向装置内通入除去二氧化碳的空气,排尽装置内的二氧化碳,故应打开K1、K3,关闭K2、K4;然后从分液漏斗中加入硫酸,充分反应;故应关闭K1、K3,打开K2、K4;反应完毕,容器内残留部分二氧化碳,应向装置内通入除去二氧化碳的空气,排出装置内的二氧化碳使反应生成的二氧化碳被装置D完全吸收,否则会导致二氧化碳测定的质量偏低,测定碳酸铜的质量分数偏低;
④装置D的质量增加的ng为反应生成的二氧化碳的质量,计算二氧化碳的物质的量,根据碳元素守恒可知n(CuCO3)=n(CO2),进而计算沉淀中CuCO3的质量分数;
(3)除题中实验方案外,还可以通过测量CO2的体积或测量样品质量和样品充分灼烧后的质量等方法来测定沉淀中CuCO3的质量分数.
解答:解:(1)甲同学认为沉淀是CuCO3,则发生反应为Na2CO3+CuSO4═CuCO3↓+Na2SO4,该反应符合复分解反应,故答案为:复分解反应;
(2)①在研究沉淀物组成前,须将沉淀从溶液中分离并净化,需要过滤、洗涤、干燥,故答案为:过滤;
②实验通过测定D装置质量装置确定二氧化碳的质量,进而确定沉淀中碳酸铜的质量,计算碳酸铜的质量分数.装置E中碱石灰的作用是吸收空气中的CO2和水蒸气,防止空气中CO2和水蒸气进入装置D影响二氧化碳的质量测定,故答案为:防止空气中CO2和水蒸气进入装置D影响二氧化碳的质量测定;
③实验通过测定D装置质量装置确定二氧化碳的质量,进而确定沉淀中碳酸铜的质量,计算碳酸铜的质量分数.开始装置内含有二氧化碳,应向装置内通入除去二氧化碳的空气,排尽装置内的二氧化碳,故应打开K1、K3,关闭K2、K4;然后从分液漏斗中加入硫酸,充分反应;故应关闭K1、K3,打开K2、K4;反应完毕,容器内残留部分二氧化碳,应向装置内通入除去二氧化碳的空气,排出装置内的二氧化碳使反应生成的二氧化碳被装置D完全吸收,故正确的顺序是cab;
反应完毕,容器内残留部分二氧化碳,应向装置内通入除去二氧化碳的空气,排出装置内的二氧化碳使反应生成的二氧化碳被装置D完全吸收,否则会导致二氧化碳测定的质量偏低,测定碳酸铜的质量分数偏低,
故答案为:cab;b;
④装置D的质量增加的ng为反应生成的二氧化碳的质量,二氧化碳的物质的量为
=
mol,根据碳元素守恒可知n(CuCO3)=n(CO2)=
mol,故碳酸铜的质量为
mol×124g/mol=
g,故沉淀中CuCO3的质量分数为
×100%=
×100%,
故答案为:
×100%;
(3)除题中实验方案外,还可以通过测量CO2的体积或测量样品质量和样品充分灼烧后的质量等方法来测定沉淀中CuCO3的质量分数,故答案为:样品质量和样品充分灼烧后的质量.
(2)①在研究沉淀物组成前,须将沉淀从溶液中分离并净化,需要过滤、洗涤、干燥,故答案为:过滤;
②实验通过测定D装置质量装置确定二氧化碳的质量,进而确定沉淀中碳酸铜的质量,计算碳酸铜的质量分数.装置E中碱石灰的作用是吸收空气中的CO2和水蒸气,防止空气中CO2和水蒸气进入装置D影响二氧化碳的质量测定,故答案为:防止空气中CO2和水蒸气进入装置D影响二氧化碳的质量测定;
③实验通过测定D装置质量装置确定二氧化碳的质量,进而确定沉淀中碳酸铜的质量,计算碳酸铜的质量分数.开始装置内含有二氧化碳,应向装置内通入除去二氧化碳的空气,排尽装置内的二氧化碳,故应打开K1、K3,关闭K2、K4;然后从分液漏斗中加入硫酸,充分反应;故应关闭K1、K3,打开K2、K4;反应完毕,容器内残留部分二氧化碳,应向装置内通入除去二氧化碳的空气,排出装置内的二氧化碳使反应生成的二氧化碳被装置D完全吸收,故正确的顺序是cab;
反应完毕,容器内残留部分二氧化碳,应向装置内通入除去二氧化碳的空气,排出装置内的二氧化碳使反应生成的二氧化碳被装置D完全吸收,否则会导致二氧化碳测定的质量偏低,测定碳酸铜的质量分数偏低,
故答案为:cab;b;
④装置D的质量增加的ng为反应生成的二氧化碳的质量,二氧化碳的物质的量为
| ng |
| 44g/mol |
| n |
| 44 |
| n |
| 44 |
| n |
| 44 |
| 31n |
| 11 |
| ||
| mg |
| 31n |
| 11m |
故答案为:
| 31n |
| 11m |
(3)除题中实验方案外,还可以通过测量CO2的体积或测量样品质量和样品充分灼烧后的质量等方法来测定沉淀中CuCO3的质量分数,故答案为:样品质量和样品充分灼烧后的质量.
点评:本题考查学生对实验原理与装置的理解评价、对实验操作的理解、物质含量的测定、化学计算等,难度中等,是对所学知识的综合运用,需要学生具备扎实的基础知识与分析问题、解决问题能力.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
 (2010?西城区一模)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
(2010?西城区一模)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
