题目内容
【题目】向一定量的NaOH 溶液中逐滴加入AlCl3溶液,生成沉淀A1(OH)3的量随AlCl3加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是
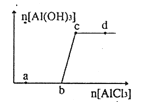
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Na+、S2-、SO42-、Cl-
C. c点对应的溶液中:Ag+、Ca2+、NO3-、F-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
【答案】B
【解析】向一定量的NaOH溶液中逐滴加入AlCl3溶液,开始时NaOH过量,发生的反应是:AlCl3+4NaOH=NaAlO2+2H2O,当NaOH完全反应后再加入AlCl3溶液,反应的方程式是:AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl,所以bc段对应的是AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl,b之前发生的是AlCl3+4NaOH=NaAlO2+2H2O。
A项,根据上述分析,在a点,NaOH尚未完全反应,有NaOH剩余,会与Fe3+反应生成沉淀、与HCO3反应生成CO32-和H2O,故不能大量共存,A错误;B项,在b点,NaOH恰好完全反应,溶液中溶质是NaAlO2,与Na+、S2、SO42、Cl互相之间都不反应,故可以大量共存,B正确;C项,在c点,溶液中的NaAlO2恰好与AlCl3完全反应,溶液中的溶质是NaCl,Cl-会和Ag+反应生成沉淀,故不能大量共存,所以C错误;D项,d点,AlCl3溶液过量,Al3+会与CO32-发生双水解反应,故不能大量共存,所以D错误。此题答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】下表中金属的冶炼原理与方法不完全正确的是( )
选项 | 冶炼原理 | 方法 |
A | 2HgO=2Hg+O2 | 热分解法 |
B | 2Al2O3 (熔融)=4Al+3O2 | 电解法 |
C | Cu2S+O2=2Cu+SO2 | 热分解法 |
D | Fe2O3 +2Al=2Fe+Al2O3 | 热还原法 |
A. AB. BC. CD. D