题目内容
铁是一种典型的过渡金属,铁和铁的化合物在生产和生活中有广泛的应用。完成下列计算:
(1)将11.802 g钢样粉末(只含铁和碳)于高温下置于足量的纯氧中充分反应,冷却后得到16.240 g磁性氧化铁。
①钢样中含铁________g。
②生成的CO2在标准状况下体积为________mL。
(2)向10 mL氯化铁溶液(含盐酸0.001 mol)中加入16.8 g 5%的烧碱溶液(足量),充分反应后过滤。洗涤沉淀,将洗涤液与滤液合并后稀释至250mL。取25mL稀释液,用0.100 mol/L盐酸滴定,终点时消耗盐酸的体积15.50mL。计算原溶液中Fe3+的物质的量浓度。
(3)铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)]。将一块带锈铁片放入700mL pH=0的稀硝酸中充分反应,收集到标准状况下NO气体3.584 L,最终剩余2.020g铁。求:
①反应后溶液中溶质的成分与物质的量。
②原带锈铁片中铁锈的质量分数。
(4)用FeSO4和NaOH制备Fe(OH)2时,往往会形成一种灰绿色的中间物(用X表示)。经分析,X中含有三种阴离子与两种阳离子,阴、阳离子的总质量之比为11:12。已知两种阳离子为Fe2+与Fe3+,物质的量之比为2:1。请通过计算确定X的化学式。
(1)将11.802 g钢样粉末(只含铁和碳)于高温下置于足量的纯氧中充分反应,冷却后得到16.240 g磁性氧化铁。
①钢样中含铁________g。
②生成的CO2在标准状况下体积为________mL。
(2)向10 mL氯化铁溶液(含盐酸0.001 mol)中加入16.8 g 5%的烧碱溶液(足量),充分反应后过滤。洗涤沉淀,将洗涤液与滤液合并后稀释至250mL。取25mL稀释液,用0.100 mol/L盐酸滴定,终点时消耗盐酸的体积15.50mL。计算原溶液中Fe3+的物质的量浓度。
(3)铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)]。将一块带锈铁片放入700mL pH=0的稀硝酸中充分反应,收集到标准状况下NO气体3.584 L,最终剩余2.020g铁。求:
①反应后溶液中溶质的成分与物质的量。
②原带锈铁片中铁锈的质量分数。
(4)用FeSO4和NaOH制备Fe(OH)2时,往往会形成一种灰绿色的中间物(用X表示)。经分析,X中含有三种阴离子与两种阳离子,阴、阳离子的总质量之比为11:12。已知两种阳离子为Fe2+与Fe3+,物质的量之比为2:1。请通过计算确定X的化学式。
(本题共16分)(1) ①11.76(2分);②78.4(2分); (2)0.15mol/L(3分);
(3)①Fe(NO3)2(1分),0.27mol(1分);②0.10(或10%,3分);
(4)Fe6(SO4)2(OH)4O3(2FeSO4·2Fe(OH)2·Fe2O3、2FeSO4·Fe(OH)2·Fe3O4·H2O等亦可,4分)
(3)①Fe(NO3)2(1分),0.27mol(1分);②0.10(或10%,3分);
(4)Fe6(SO4)2(OH)4O3(2FeSO4·2Fe(OH)2·Fe2O3、2FeSO4·Fe(OH)2·Fe3O4·H2O等亦可,4分)
试题分析:(1)①16.240 g磁性氧化铁中铁元素的质量是16.24g×
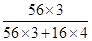 =11.76g,所以根据铁原子守恒可知,钢样中含铁11.76g。
=11.76g,所以根据铁原子守恒可知,钢样中含铁11.76g。②钢样中碳元素的质量是11.802 g-11.76g=0.042g,物质的量=0.042g÷12g/mol=0.0035mol,所以根据碳原子守恒可知,生成的CO2的物质的量也是0.0035mol,在标准状况下的体积是0.0035mol×22.4L/mol=0.0784L=78.4ml。
(2)氢氧化钠的质量是16.8 g×5%=0.84g,氢氧化钠的物质的量是0.84g÷40g/mol=0.021mol,则根据钠离子守恒可知最终生成的氯化钠是0.021mol。原溶液中含有的盐酸和加入的盐酸的物质的量之和=0.100 mol/L×0.0155L×10+0.001mol=0.0165mol,所以根据氯离子守恒可知,氯化铁中氯离子的物质的量是0.021mol-0.0165mol=0.0045mol,则氯化铁的物质的量是0.0045mol÷3=0.0015mol,所以铁离子的浓度是0.0015mol÷0.01L=0.15mol/L。
(3)①反应后铁过量,所以最终溶液中的成分是Fe(NO3)2。硝酸的物质的量是0.7L×1mol/L=0.7mol,NO的物质的量是3.584L÷22.4L/mol=0.16mol,所以根据氮原子守恒可知,生成的硝酸亚铁的物质的量是(0.7mol-0.16mol)÷2=0.27mol。
②假设铁锈的物质的量是x,铁的物质的量是y,则根据铁原子守恒可知x+y=2.020g÷56g/mol+0.27mol。根据电子得失守恒可知x+0.16mol×3=(y-2.020g÷56g/mol)×2,解得x=0.02mol、y=0.286mol所以铁锈的质量分数=
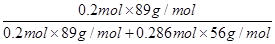 =0.1。
=0.1。(4)设有2mol Fe2+和1mol Fe3+,其铁元素质量是3mol×56g/mol=168g
由于阴、阳离子的总质量之比为11:12
所以阴离子共168g×
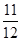 =154g,且带有7mol负电荷
=154g,且带有7mol负电荷所以SO42-只有1mol(96g)
剩余两种阴离子共58g,且带有5mol负电荷。
因为5mol OH—为85g,因此第三种阴离子只能为质量轻、电荷多的O2-
设OH—和O2-的物质的量分别是x和y
则x+2y=5、17x+16y=58
解得x=2mol、y=1.5mol
因此三种阴离子的物质的量之比是2:4:3
所以化学式是Fe6(SO4)2(OH)4O3

练习册系列答案
相关题目



 H2
H2 Cu ②CuO
Cu ②CuO Cu
Cu