题目内容
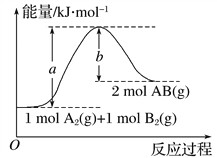
【题目】某同学组装了如图所示的电化学装置,其中电极I为Al,其它均为Cu,下列说法正确的是( )

A. 装Al2(SO4)3溶液的烧杯是原电池,其余两个为电解(电镀)池
B. 盐桥中电子从右侧流向左侧
C. 电极II逐渐溶解
D. 电极IV的电极反应:Cu2+ + 2e-= Cu
【答案】D
【解析】试题分析:A、由原电池的构成条件及题意可知,图中左、中两个烧杯中电解质溶液、盐桥和外电路组成1个原电池,右边烧杯为电解(或电镀)池,A错误;B、I中较活泼的Al电极为负极,II中较不活泼的Cu为正极,外电路(导线)中电子从左流向右,内电路(含盐桥)中带正电的阳离子从左侧流向右侧,带负电的阴离子从右侧流向左侧,内电路中无电子的定向移动,B正确;C、负极反应式为Al-3e-=Al3+,则电极I逐渐溶解或被腐蚀,而作为正极的II则受到保护,C错误;D、III为阴极,内电路中带正电的铜离子移向阴极,则阴极反应式为Cu2+ + 2e-= Cu,IV是阳极,则阳极反应式为Cu- 2e-= Cu2+,D错误;答案选D。

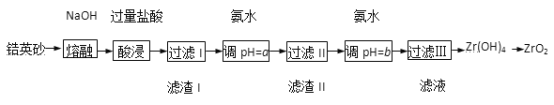
【题目】下表为元素周期表前四周期的一部分,下列叙述正确的是( )

A. Y单质在空气中燃烧生成YO3
B. Z元素的最高价氧化物的水化物酸性最强
C. X的氢化物为H2X
D. Y、Z和W的阴离子半径依次增大
【题目】将氯气通入到水中所发生反应的化学方程式为______________________。已知生成物之一是一种弱酸,试写出该物质在水溶液中的电离方程式______________。某同学将有色布条浸泡在新制的氯水中,发现布条很快被漂白。对此他认为可能是因为氯水中含有某种粒子使布条褪色,于是他提出如下的假设,请你帮他设计实验方案以验证他的假设。
编号 | 假设原因 | 验证方案 |
1 | 可能是因为Cl2分子 | A:_____________ |
2 | 可能是因为H+ | B:_____________ |
3 | 可能是因为Cl- | C:_____________ |
4 | 可能是因为HClO | ———————————————— |
5 | 可能是因为ClO- | D:_____________ |